
题目列表(包括答案和解析)
10.下列溶液中离子浓度的关系一定正确的是( )
A.Na2CO3与NaHCO3的混合溶液中:c(Na+) + c(H+) = c(OH-) + c(HCO3-) + c(CO32-)
B.一元弱碱MOH对应的盐MCl的溶液中:c(Cl-)>c(H+)>c(M+)<c(OH-)
C.等物质的量浓度的二元弱酸H2X与其钾盐K2X溶液等体积混合后所得溶液中:c(K+)=c(X2-)+c(HX-)+c(H2X)
D.pH=5的稀盐酸加水稀释1000倍后所得溶液中:c(Cl-)>c(OH-)>c(H+)
9.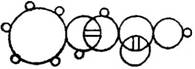 奥地利杰出的化学家约瑟夫·劳施密特在他所著的《化学研究》中有如图所示的物质圆圈图,即肉桂酸(C9H8O2)的分子结构,下列有关肉桂酸的说法中错误的是( )
奥地利杰出的化学家约瑟夫·劳施密特在他所著的《化学研究》中有如图所示的物质圆圈图,即肉桂酸(C9H8O2)的分子结构,下列有关肉桂酸的说法中错误的是( )
A.肉桂酸的结构简式为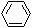 -CH=CH-COOH
-CH=CH-COOH
B.肉桂酸与 互为同分异构体
互为同分异构体
C.肉桂酸能发生加成反应、酯化反应和氧化反应
D.肉桂酸能发生加聚反应生成蛋白质
8.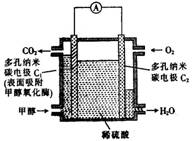 酶生物燃料电池(BFC)是以有机物为燃料,利用酶作催化剂的一种特殊的燃料电池,能量转化效率高,其工作原理如图所示,下列有关说法中不正确的是()
酶生物燃料电池(BFC)是以有机物为燃料,利用酶作催化剂的一种特殊的燃料电池,能量转化效率高,其工作原理如图所示,下列有关说法中不正确的是()
A. C1极产生的质子经外电路导线流向C2极
B.C2极的电极反应式为O2 + 4H+ + 4e- === 2H2O
C. C1极为电池负极,C2极为电池正极
D.C1极的电极反应式为CH3OH + H2O – 6e- === CO2↑+ 6H+
7.据2009年4月6日搜狐网站报道:国家质检总局称,在我国销售的德国NUK牌婴儿爽身粉含有一级致癌物“滑石粉”。己知滑石粉的化学式为Mg3(Si4O10)(OH)2,色白、滑爽、柔软、耐火性。下列有关说法不正确的 ( )
A.滑石粉属于无机硅酸盐类物质
B. 滑石粉组成可表示为3MgO·4SiO2·H2O
C.爽身粉中添加滑石粉是利用它的滑爽、柔软、耐火性
D.滑石粉可能会与氢氟酸、NaOH溶液发生反应
2009.5.15
6下列说法正确的是 ( )
A,用漏斗从鸡蛋白的盐水溶液中分离出鸡蛋白
B棉花和木材的主要成分都是纤维素,蚕丝和蜘蛛丝的主要成分都是蛋白质
C液氨泄漏事故发生时,应该朝顺风方向逃离或向避风的沟塘低洼处转移
D用加热的方法提取氯化铵固体中混有的少量碘
27.(15分)
某白色粉末其成分可能是碳酸钠和亚硫酸钠的一种或两种组成。请完成对该白色粉末成分的探究:
限选实验仪器:药匙、试管、单孔塞、导管、玻璃棒、滴管、带铁夹的铁架台。
限选实验试剂:1 mol·L-1H2SO4、3%H2O2、澄清石灰水、品红试液。
(1)提出合理假设
假设1: ;
假设2: ;
假设3: 。
(2)设计实验方案证明你的假设
(3)实验过程
根据(2)的实验方案,进行实验。请在答题纸上按下表格式写出实验操作步骤、预期现象与结论。
|
实验操作 |
预期现象与结论 |
|
步骤1:检查装置气密性… |
|
|
步骤2: |
|
|
… |
|
化学-化学与技术
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
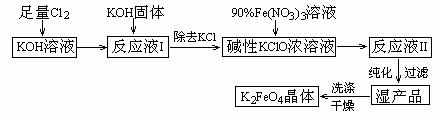
已知:① 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH → 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为 ;
(5)在“反应液I”中加KOH固体的目的是 :
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
化学-物质结构与性质(15分)
(1)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是________ _______,画出配合物离子 [Cu(NH3)4]2+中的配位键__________ __________ 。
(2)根据VSEPR模型,H3O+的分子立体结构为___________ ________________,
BCl3的立体结构为___________ _________________。
(3)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式
(各写一种)
正四面体分子_______,三角锥形分子________,V形分子_________。
化学-有机化学基础(15分)
已知: 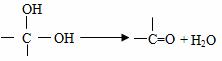
下图中X分子式为C4H2Br2O4,为六元环化合物,核磁共振氢谱表明其分子中只有一种类型H原子的吸收峰。
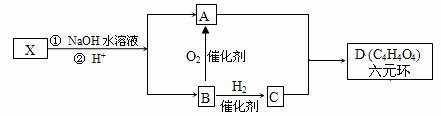
(1)D中所含官能团的名称 。
(2)X的结构简式 。它可以发生 (填字母)
a、取代反应 b、消去反应 c、加成反应
(3)写出A和C按1:1反应生成聚合物的化学方程式。
。
(4)D有多种同分异构体,写出满足以下条件的任意两种同分异构体的结构简式
a、能与NaHCO3溶液反应放出气泡 b、能发生水解反应 c、分子内含有环状结构
、
(5)根据题示信息,用乙炔为主要原料设计合成路线合成HOCH2CHO。
要求:①合成路线用反应流程图表示。
②标明每一步的反应物及反应条件。(有机物写结构简式,其它原料自选)
例:由乙醇合成聚乙烯的反应流程图可表示为
CH3CH2OH浓硫酸170℃CH2=CH2高温、高压催化剂 CH2-CH2
CH2-CH2
_______________________________________________________________________
26.(15分)
蛭(zhi)石可以用来生产耐火材料MgO和A12O3,其主要成分为MgO、Fe2O3、A12O3、SiO2。某中学化学小组设计了如下方案,利用蛭石来制备单质镁、铝、硅。(假设每次转化所得固体成分只有一种)
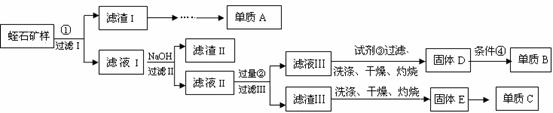
(1)图中标号处需加入的相应物质分别是① ②
(2)写出单质A的一种用途
(3)已知此温度下Fe(OH)3的Ksp=1.0×10-38,向滤液Ⅰ中加NaOH将溶液的pH控制在大于 ,小于4.1(此时Al3+开始沉淀)
(4)加入试剂③时反应的离子方程式是
(5)由固体E生产单质C的化学方程式
(6)条件④是
25.(13分)
硫及其化合物在生产、生活中有广泛的应用,请回答下列问题:
(1)已知S的燃烧热为297kJ·mol-1,H2S完全燃烧的热化学方程式为H2S(g)+1.5O2(g)=SO2(g) +H2O (l) △H=-586. kJ/mol,H2S不完全燃烧生成固态硫和液态水。写出H2S不完全燃烧的热化学方程式________________________;
(2)SO2溶于水生成弱酸H2SO3,写出H2SO3的电离方程式______________;
(3)Na2SO3溶液通常现用现配,写出Na2SO3溶液所含离子浓度的大小关系(由大到小)
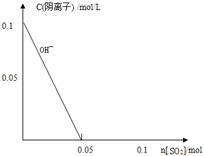 ____________________________________________________________________;
____________________________________________________________________;
(4)向1L0.1mol/L的NaOH溶液中不断通入标准状况下的SO2气体2.24L(假设溶液体积一直保持不变),请在右图中画出SO2通入过程中溶液中各阴离子浓度与SO2物质的量的关系变化图像(如图中OH—所示)。
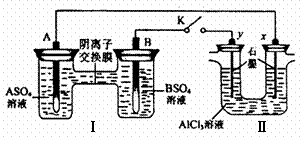
13.某同学按右图所示的装置进行试验。A、B为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42一从右向左移动。下列说法中错误的是
A.B电极质量增加
B.电解一段时间后,向Ⅱ装置中通入适量HCl气体可以恢复原来的浓度和体积
C.反应初期,y电极周围出现白色胶状沉淀
D.x电极产生气泡,且生成1mol气体的同时,有1molA参与反应
12.2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应
PCl3(g)+ Cl2(g)  PCl5(g)达平衡时, PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达到平衡PCl5的物质的量是
PCl5(g)达平衡时, PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达到平衡PCl5的物质的量是
 A.0.40mol B.0.20mol C.小于0.20mol D.大于0.20mol,小于0.40mol
A.0.40mol B.0.20mol C.小于0.20mol D.大于0.20mol,小于0.40mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com