
题目列表(包括答案和解析)
1、(1)A、Fe B、Cl2 C、H2
(2) 2Fe+3Cl2 2FeCl3
(3)Fe+2H+=Fe2++H2↑
(4)2Fe2++Cl2=2Fe3++2Cl-
2、SiO2;CaSiO3;Na2SiO3;Si;H4SiO4(H2SiO3 )
3、C
4、⑴A.N2;B.NH3;C.NO;D.NO2;E.HNO3;4NH3+5O2
2FeCl3
(3)Fe+2H+=Fe2++H2↑
(4)2Fe2++Cl2=2Fe3++2Cl-
2、SiO2;CaSiO3;Na2SiO3;Si;H4SiO4(H2SiO3 )
3、C
4、⑴A.N2;B.NH3;C.NO;D.NO2;E.HNO3;4NH3+5O2 4NO+6H2O
⑵ 2H2S+3O2
4NO+6H2O
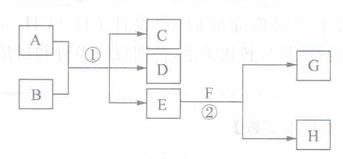
⑵ 2H2S+3O2 2SO2+2H2O )
5、碳、二氧化碳、碳酸钙、碳酸氢钙 CO2+Ca2++2OH-==CaCO3↓+H2O
CaCO3+CO2+H2O==Ca2++2HCO3- HCO3-+H+==CO2↑+H2O
HCO3-+OH-==CO32-+H2O
6、A:CO2、NO2; B:NO
C:Cu D:Cu(NO3)2溶液
7、① NH3、NO、CO2,NO2、HCl、H2②NO和CO2,2:3
8、(1)
2SO2+2H2O )
5、碳、二氧化碳、碳酸钙、碳酸氢钙 CO2+Ca2++2OH-==CaCO3↓+H2O
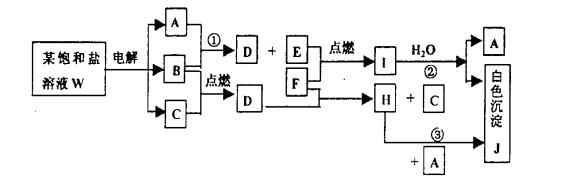
CaCO3+CO2+H2O==Ca2++2HCO3- HCO3-+H+==CO2↑+H2O
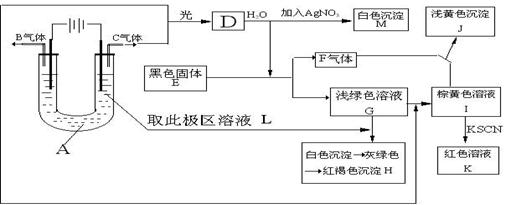
HCO3-+OH-==CO32-+H2O
6、A:CO2、NO2; B:NO
C:Cu D:Cu(NO3)2溶液
7、① NH3、NO、CO2,NO2、HCl、H2②NO和CO2,2:3
8、(1)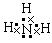 (2)2F2 + 2H2O = 4HF + O2, 4NH3 + 5O2
(2)2F2 + 2H2O = 4HF + O2, 4NH3 + 5O2  4NO +
6H2O
(3)能。(6NO + 4NH3 =
5N2 + 6H2O,根据NO、NH3中N的化合价判断,NO2与NH3也能反应,二者都属化合价归中反应)
9、(1)略NH4NO3(2)4NH3+5O2=4NO+6H2O 3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
10、⑴ X:NH4HCO3或(NH4)2CO3 C: NH3 E:
NO F: NO2
⑵2Na2O2+2CO2==2Na2CO3+O2
⑶8H++2NO3-+3Cu==3Cu2++2NO↑+4H2O
11、(1)H2 ,H∶H(2)2F2 + 2H2O == 4HF + O2,5O2 + 4NH3===4NO + 6H2O(3)能,4NH3 + 6NO == 5N2
+ 6H2O
4NO +
6H2O
(3)能。(6NO + 4NH3 =
5N2 + 6H2O,根据NO、NH3中N的化合价判断,NO2与NH3也能反应,二者都属化合价归中反应)
9、(1)略NH4NO3(2)4NH3+5O2=4NO+6H2O 3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
10、⑴ X:NH4HCO3或(NH4)2CO3 C: NH3 E:
NO F: NO2
⑵2Na2O2+2CO2==2Na2CO3+O2
⑶8H++2NO3-+3Cu==3Cu2++2NO↑+4H2O
11、(1)H2 ,H∶H(2)2F2 + 2H2O == 4HF + O2,5O2 + 4NH3===4NO + 6H2O(3)能,4NH3 + 6NO == 5N2
+ 6H2O
 12、(1)2S2―+SO32―+6H+=3S↓+3H2O
(2)Al3++3HCO3―=Al(OH)3↓+3CO2↑
(3)BaCO3或BaCO3与BaSO4的混合物;在所得沉淀丙中加入稀盐酸,若沉淀全部溶解,说明沉淀丙是BaCO3 ,若沉淀仅部分溶解,说明沉淀是BaCO3和BaSO4的混合物。
(4)气体甲有5种可能:①H2S②SO2 ③CO2④CO2和H2S ⑤CO2和SO2(5)Na+
、S2―、SO32―、AlO2―;Ag+、Ba2+、Al3+;CO32―、SO42―
13、(1)二氧化硅、氧化钙、碳化钙。(2)复分解反应。(3)Si+2NaOH+2H2O=Na2SiO3+2H2+H2O。(4)HC≡CH+HCl
12、(1)2S2―+SO32―+6H+=3S↓+3H2O
(2)Al3++3HCO3―=Al(OH)3↓+3CO2↑
(3)BaCO3或BaCO3与BaSO4的混合物;在所得沉淀丙中加入稀盐酸,若沉淀全部溶解,说明沉淀丙是BaCO3 ,若沉淀仅部分溶解,说明沉淀是BaCO3和BaSO4的混合物。
(4)气体甲有5种可能:①H2S②SO2 ③CO2④CO2和H2S ⑤CO2和SO2(5)Na+
、S2―、SO32―、AlO2―;Ag+、Ba2+、Al3+;CO32―、SO42―
13、(1)二氧化硅、氧化钙、碳化钙。(2)复分解反应。(3)Si+2NaOH+2H2O=Na2SiO3+2H2+H2O。(4)HC≡CH+HCl  CH2=CHCl。
14、⑴ ⅢA族ⅥA族 ⑵ Al2S3 ⑶ 2/3mol
15、(1)硫化铵(或硫氢化钠)(2)水(碱溶液)
酸(盐)(3)2H2S+3O2
CH2=CHCl。
14、⑴ ⅢA族ⅥA族 ⑵ Al2S3 ⑶ 2/3mol
15、(1)硫化铵(或硫氢化钠)(2)水(碱溶液)
酸(盐)(3)2H2S+3O2
2SO2+2H2O 4NH3+5O2 4NO+6H2O
(4)4NH3+6NO 5N2+6H2O
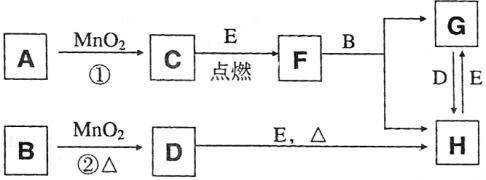
16、本题为框图题,有一定难度。分析起点:F不溶于水,加E溶解,推知E可能为酸,E非常易溶于水推知E为HCl。其次G水溶液为棕黄色推知G为FeCl3,进一步推知H为FeCl2、A为H2。在综合G与I反应生成FeCl2、HCl及单质D推知I为H2S,D为S。答案:(1)H2 Cl2 Fe S (2)FeS + 2H+=Fe2+ + H2S↑
(3)2FeCl3 + H2S=FeCl2 + S↓ + 2HCl
17、⑴A是(NH4)2CO3或(NH4HCO3),F是N2,X是H2,Y是Cl2。
⑵CO2+2NaOH=Na2CO3+H2O(或CO2+NaOH=NaHCO3) ⑶N2+3H2
 2NH3
18、解析:A盐固体受热分解为三种物质,且为非氧化还原反应。由此很容易想到可能是(NH4)2CO3或NH4HCO3。又因为电解Z盐溶液生成三种物质,其中两种物质(X和Y)为单质,且X与F化合生成D,结合这两点,X应为H2,F为N2,D为NH3。这样Z盐应似NaCl或KCl,则Y为Cl2,W为NaOH或KOH,A盐确实为(NH4)2CO3或NH4HCO3,B为CO2,G为Na2CO3或NaHCO3,C为水,E为HCl或NH4Cl(NH3过量时)。答案:(1)(NH4)2CO3或NH4HCO3 N2 H2 Cl2
(2)CO2+2NaOH====Na2CO3+H2O或CO2+NaOH====NaHCO3 (3)N2+3H2
2NH3
18、解析:A盐固体受热分解为三种物质,且为非氧化还原反应。由此很容易想到可能是(NH4)2CO3或NH4HCO3。又因为电解Z盐溶液生成三种物质,其中两种物质(X和Y)为单质,且X与F化合生成D,结合这两点,X应为H2,F为N2,D为NH3。这样Z盐应似NaCl或KCl,则Y为Cl2,W为NaOH或KOH,A盐确实为(NH4)2CO3或NH4HCO3,B为CO2,G为Na2CO3或NaHCO3,C为水,E为HCl或NH4Cl(NH3过量时)。答案:(1)(NH4)2CO3或NH4HCO3 N2 H2 Cl2
(2)CO2+2NaOH====Na2CO3+H2O或CO2+NaOH====NaHCO3 (3)N2+3H2 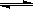 2NH3
19、(1)H2 (2)第二 IVA H:C∷C:H (3) H2O+C
2NH3
19、(1)H2 (2)第二 IVA H:C∷C:H (3) H2O+C  CO+H2
3Fe+4H2O
CO+H2
3Fe+4H2O  Fe3O4+4H2↑ Fe+NO3-+4H+==Fe3++NO↑+2 H2O
20、(1)H2、CO、C2H2 (2)SiO32-+CO2+H2O
Fe3O4+4H2↑ Fe+NO3-+4H+==Fe3++NO↑+2 H2O
20、(1)H2、CO、C2H2 (2)SiO32-+CO2+H2O
H2SiO3+CO32- Ca(OH)2+CO2+CO2
CaCO3↓+H2O
21、(1) HF、H2O、NH3、NO (2) 2F2 + 2 ==4HF+ O2 4NH3+
5O2==4NO +6H2O 4NH3+ NO==5N2 +6H2O
22、(1)Fe3O4,
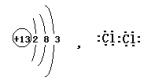 (2)Al3++3AlO2-+6H2O====4Al(OH)3↓ (3)4FeCl2+O2+8NaOH+2H2O====4Fe(OH)3+8NaCl
或FeCl2+2NaOH====Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O====4Fe(OH)3
(2)Al3++3AlO2-+6H2O====4Al(OH)3↓ (3)4FeCl2+O2+8NaOH+2H2O====4Fe(OH)3+8NaCl
或FeCl2+2NaOH====Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O====4Fe(OH)3
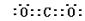 23、(1)O2 (2)略
(3)2SO2+O2===2SO3
2H2O =====2H2+O2
24、(1)硝酸第四周期,Ⅷ族(2)2Na2O2+2CO2=2Na2CO3+O2
2Fe3++2CO32-+3H2O=2Fe(OH)3↓+3CO2↑
25、(1)NH4HCO3或(NH4)2CO3 NO2 (2)4NH3+5O2
23、(1)O2 (2)略
(3)2SO2+O2===2SO3
2H2O =====2H2+O2
24、(1)硝酸第四周期,Ⅷ族(2)2Na2O2+2CO2=2Na2CO3+O2
2Fe3++2CO32-+3H2O=2Fe(OH)3↓+3CO2↑
25、(1)NH4HCO3或(NH4)2CO3 NO2 (2)4NH3+5O2  4NO+6H2O
(3)2CO2+2Na2O2=2Na2CO3+O2
26、(1)W:NH4Cl、C:H2
(2)2 NH4Cl=Cl2↑+H2↑+NH3↑ (3)①:3 Cl2+2NH3=6HCl+N2、②:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ (4)Mg2++2NH3+2H2O=Mg(OH)2↓+2NH4+ (5)略
27、(1)A:KCl E:硫化亚铁 (2)2Fe3++H2S=2Fe2++S↓+2H+ (3) 4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)①2Fe3++Cu=2Fe2++Cu2+、 Fe+Cu2+=Fe2++Cu↓
28、(1)H3PO4
(2)5;4 (3)PCl5+4H2O
4NO+6H2O
(3)2CO2+2Na2O2=2Na2CO3+O2
26、(1)W:NH4Cl、C:H2
(2)2 NH4Cl=Cl2↑+H2↑+NH3↑ (3)①:3 Cl2+2NH3=6HCl+N2、②:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ (4)Mg2++2NH3+2H2O=Mg(OH)2↓+2NH4+ (5)略
27、(1)A:KCl E:硫化亚铁 (2)2Fe3++H2S=2Fe2++S↓+2H+ (3) 4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)①2Fe3++Cu=2Fe2++Cu2+、 Fe+Cu2+=Fe2++Cu↓
28、(1)H3PO4
(2)5;4 (3)PCl5+4H2O H3PO4+5HCl
29、(1)NO H2 (2)三角锥型 (3)3Mg+N2=Mg3N2
(4)4NH3+5O2 4NO+6H2O
(5)高 NO2分子相互反应有N2O4生成(2NO2
N2O4)
30、(1)K2SO3、BaCl2 (2)SO2+Cl2+2H2O=4H++SO42-+Cl- (3)(4)略(5)2KCl+2H2O=2KOH+H2↑+ Cl2 ↑
31、(1)2H2+O2=2H2O(2)Al(或Si)(3)2Na2O2+2H2O=4NaOH+O2↑ Al2O3+2NaOH=2NaAlO2+H2O(或SiO2+2NaOH=Na2SiO3+H2O)
4NO+6H2O
(5)高 NO2分子相互反应有N2O4生成(2NO2
N2O4)
30、(1)K2SO3、BaCl2 (2)SO2+Cl2+2H2O=4H++SO42-+Cl- (3)(4)略(5)2KCl+2H2O=2KOH+H2↑+ Cl2 ↑
31、(1)2H2+O2=2H2O(2)Al(或Si)(3)2Na2O2+2H2O=4NaOH+O2↑ Al2O3+2NaOH=2NaAlO2+H2O(或SiO2+2NaOH=Na2SiO3+H2O) 32、(1)H2O
(2)Na2S (3)2Al(OH)3
32、(1)H2O
(2)Na2S (3)2Al(OH)3 Al2O3+3H2O
(4)2H2S+SO2
Al2O3+3H2O
(4)2H2S+SO2
3S+2H2O
33、(1)NaOH NH3·H2O NaHCO3 Ba(NO3)2 Al2(SO4)3
(2)略 (3)Al3++3HCO3-=Al(OH)3↓+3CO2↑  34、(1)
34、(1)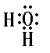 3Fe+4H2O(气)
3Fe+4H2O(气) 
 说明:不写条件扣分,不配平扣分,化学式写错不得分(下同)
说明:不写条件扣分,不配平扣分,化学式写错不得分(下同) (2)Mg ,O=C=O, 2Mg+CO2
(2)Mg ,O=C=O, 2Mg+CO2 2MgO+C
说明:答案合理均给分。
35、(1)FeCl2 、Na2S、FeSO4、Fe(OH)3 (2)①FeS+2H+=Fe2++H2S↑②SO2+2Fe3++2H2O=SO42-
+2Fe2++4H+ ③Fe3++3OH-=Fe(OH)3↓
36、(1)
2MgO+C
说明:答案合理均给分。
35、(1)FeCl2 、Na2S、FeSO4、Fe(OH)3 (2)①FeS+2H+=Fe2++H2S↑②SO2+2Fe3++2H2O=SO42-
+2Fe2++4H+ ③Fe3++3OH-=Fe(OH)3↓
36、(1) 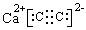 (2)2NaCl+2H2O
(2)2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2NaOH+H2↑+Cl2↑
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
 37、(1)Fe NO Mg(2)①C+4HNO3(浓)
37、(1)Fe NO Mg(2)①C+4HNO3(浓) CO2↑+4NO2↑+2H2O ②3Fe(NO3)2+4HNO3(稀)=3Fe(NO3)3+NO↑+2H2O
③2Mg+CO2
2MgO+C
38、(1)A : CH4 D : CO
F : Cu乙: CuO(2)C2H2(电子式略) (3)H2O+C
CO↑+H2↑
39、(1) 
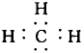 CaC2
(2)4NH3+5O2
CaC2
(2)4NH3+5O2
 4NO+6H2O
4NO+3O2+2H2O=4HNO3
(3)NH4++HCO3-+Ca2++2OH-=NH3•H2O+CaCO3↓+H2O (产物写为NH3也给分)
(4)2H++2e-=H2↑,4OH--4e-=2H2O+O2↑
40、(1)H:H(2)Fe+2FeCl3===3FeCl2
(3)碱; AlO2-+2H2O
4NO+6H2O
4NO+3O2+2H2O=4HNO3
(3)NH4++HCO3-+Ca2++2OH-=NH3•H2O+CaCO3↓+H2O (产物写为NH3也给分)
(4)2H++2e-=H2↑,4OH--4e-=2H2O+O2↑
40、(1)H:H(2)Fe+2FeCl3===3FeCl2
(3)碱; AlO2-+2H2O  Al(OH)3+OH-(4)FeO
41、(1)HCl,Fe(2)催化氧化(3)Fe3O4+8HCl
Al(OH)3+OH-(4)FeO
41、(1)HCl,Fe(2)催化氧化(3)Fe3O4+8HCl 2FeCl3+FeCl2+4H2O(4)KClO3 H2O2
;2:1
42、(1)H2SO4
,B>C或rB>rC或rN>rO (2)3H2S+SO3
4S+3H2O(未配平不得分) (3)NH4HSO4
43、(1)11.2 (2)2S2-+SO32-+6H+=3S↓+3H2O
(3)SO2+Br2+2H2O=H2SO4+2HBr;分子
(4)S(s)+O2(g)=SO2(g);ΔH=-296kJ/mol;
(5)
(2)2S2-+SO32-+6H+=3S↓+3H2O
(3)SO2+Br2+2H2O=H2SO4+2HBr;分子
(4)S(s)+O2(g)=SO2(g);ΔH=-296kJ/mol;
(5) 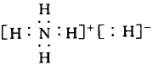 3NH5+AlCl3+3H2O=Al(OH)3↓+3NH4Cl+3H2↑(分步写也得分)
44、(1)H2;硝酸铵
(2) 4NH3+5O2
3NH5+AlCl3+3H2O=Al(OH)3↓+3NH4Cl+3H2↑(分步写也得分)
44、(1)H2;硝酸铵
(2) 4NH3+5O2
 4NO+6H2O
(3)1 :2
(4)NaCl+CO2+NH3+H2O=NH4Cl+NaHCO3↓)
(5)NH4Cl、NH4NO3 、(NH4)2SO4
、(NH4)2CO3 、NH4HCO3 (CH3COONH4 或HCOONH4 等有机酸的铵盐均可。)
4NO+6H2O
(3)1 :2
(4)NaCl+CO2+NH3+H2O=NH4Cl+NaHCO3↓)
(5)NH4Cl、NH4NO3 、(NH4)2SO4
、(NH4)2CO3 、NH4HCO3 (CH3COONH4 或HCOONH4 等有机酸的铵盐均可。)
1、室温下,单质A、B、C分别为固体、黄绿色气体、无色气体。在合适反应条件下,它们可以按下面框图进行反应;又知单质A是当今世界产量最大的金属,E是溶液是无色的。请回答:
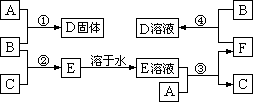 (1)A是__________,B是__________,C是__________(请填写化学式);
(2)反应①的化学方程式______________________________;
(3)反应③的离子方程式______________________________;
(4)反应④的离子方程式______________________________。
2、A、B、C、D、E五种物质均含有同一种元素,它们能发生如下图所示的变化。
(1)A是__________,B是__________,C是__________(请填写化学式);
(2)反应①的化学方程式______________________________;
(3)反应③的离子方程式______________________________;
(4)反应④的离子方程式______________________________。
2、A、B、C、D、E五种物质均含有同一种元素,它们能发生如下图所示的变化。
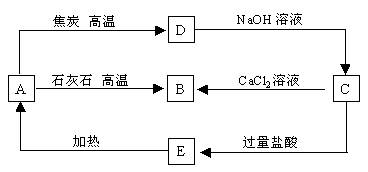 写出五种物质的化学式:A______B_______C_______D_______E__________
3、某混和气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混和气体依次通过:①澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓H2SO4( 无现象);④灼热氧化铜(变红);⑤无水硫酸铜(变蓝).(假设每一次吸收均完全).对该混和气体成分判断正确的是
A.一定没有CO2,肯定有H2 B.一定有CO、CO2和水蒸气
C.一定有H2、CO2和HCl
D.可能有CO2、NH3和水蒸气
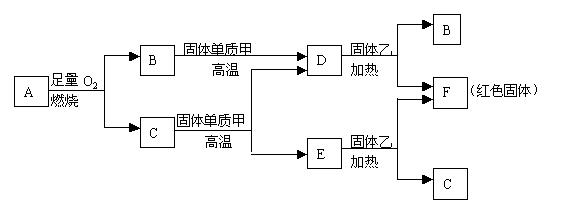
4、A、B、C、D、E五种物质在一定条件下的转化关系如图所示。
写出五种物质的化学式:A______B_______C_______D_______E__________
3、某混和气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混和气体依次通过:①澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓H2SO4( 无现象);④灼热氧化铜(变红);⑤无水硫酸铜(变蓝).(假设每一次吸收均完全).对该混和气体成分判断正确的是
A.一定没有CO2,肯定有H2 B.一定有CO、CO2和水蒸气
C.一定有H2、CO2和HCl
D.可能有CO2、NH3和水蒸气
4、A、B、C、D、E五种物质在一定条件下的转化关系如图所示。
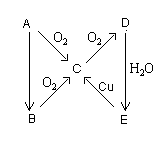 (1)若A在常温下为气态单质,则A为_______;B为_______;C为_______;D为_______;E为____;由B→C变化的化学方程式________________________________________
(2)若A在常温下为固态单质。则B→C变化的化学方程式__________________________________________________
2
5、有一种黑色粉末A在纯氧中充分燃烧生成气体B,加入少量澄清石灰水,出现白色沉淀C,振荡后沉淀消失得溶液D,把D分成两份,一份中加入稀HCl,又生成气体B,另一份加入NaOH溶液又得沉淀C。则A、B、C、D的名称依次为____________、___________、____________、____________。有关的离子方程式为:
B→C_________________________________________________________,
C→D_________________________________________________________,
D→B_________________________________________________________,
D→C_________________________________________________________。
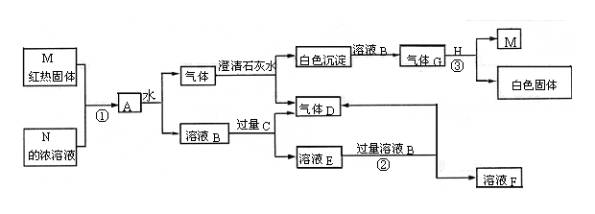
6、将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A。A在常温下不与空气接触时发生如下图所示的变化。
(1)若A在常温下为气态单质,则A为_______;B为_______;C为_______;D为_______;E为____;由B→C变化的化学方程式________________________________________
(2)若A在常温下为固态单质。则B→C变化的化学方程式__________________________________________________
2
5、有一种黑色粉末A在纯氧中充分燃烧生成气体B,加入少量澄清石灰水,出现白色沉淀C,振荡后沉淀消失得溶液D,把D分成两份,一份中加入稀HCl,又生成气体B,另一份加入NaOH溶液又得沉淀C。则A、B、C、D的名称依次为____________、___________、____________、____________。有关的离子方程式为:
B→C_________________________________________________________,
C→D_________________________________________________________,
D→B_________________________________________________________,
D→C_________________________________________________________。
6、将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A。A在常温下不与空气接触时发生如下图所示的变化。
 A是 ,B是
,C是
,D是
(填化学式)
7、一无色气体,可能由CO2、HCl、NH3、NO2、NO、H2中的一种或几种组成。将此无色气体通过盛有浓H2SO4的洗气瓶,发现气体体积减少。继续通过装有固体Na2O2的干燥管,发现从出气管出来的气体颜色显红棕色,再将该气体全部通入盛满水倒立于水槽中的试管内,发现最后试管里仍然为一满试管液体。由此可推知:①原气体中一定含有_____________,一定不会有 ____________;②最终结果可知原气体中_____________气体的体积比为_______。
8、A、B、C、D为中学化学中常见的四种气体单质。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙;C和D化合生成化合物丁。已知甲、乙、丙的每个分子中含有10个电子,并且甲、乙、丙、丁有如下关系:
A是 ,B是
,C是
,D是
(填化学式)
7、一无色气体,可能由CO2、HCl、NH3、NO2、NO、H2中的一种或几种组成。将此无色气体通过盛有浓H2SO4的洗气瓶,发现气体体积减少。继续通过装有固体Na2O2的干燥管,发现从出气管出来的气体颜色显红棕色,再将该气体全部通入盛满水倒立于水槽中的试管内,发现最后试管里仍然为一满试管液体。由此可推知:①原气体中一定含有_____________,一定不会有 ____________;②最终结果可知原气体中_____________气体的体积比为_______。
8、A、B、C、D为中学化学中常见的四种气体单质。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙;C和D化合生成化合物丁。已知甲、乙、丙的每个分子中含有10个电子,并且甲、乙、丙、丁有如下关系:
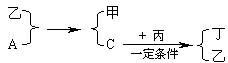 试回答:
(1)丙的电子式为___________________
(2)A和乙,单质C和丙所发生反应的化学方程式分别为______________________________,_______________________________________
(3)丙和丁能否在一定条件下反应?_________(填能或不能)。
9、右图是某元素及其重要化合物的相互转化关系图(生成物中不含该元素的物质均已略去),图中A是单质,D在常温下呈气态,F可用作化肥,也可用来作炸药。
(1)写出A的电子式 和F的化学式
;
(2)写出下列变化的化学方程式:
B→C:
E→C:
试回答:
(1)丙的电子式为___________________
(2)A和乙,单质C和丙所发生反应的化学方程式分别为______________________________,_______________________________________
(3)丙和丁能否在一定条件下反应?_________(填能或不能)。
9、右图是某元素及其重要化合物的相互转化关系图(生成物中不含该元素的物质均已略去),图中A是单质,D在常温下呈气态,F可用作化肥,也可用来作炸药。
(1)写出A的电子式 和F的化学式
;
(2)写出下列变化的化学方程式:
B→C:
E→C:
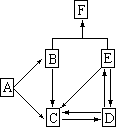 10、下图中的每一个方格表示有关的一种反应物或生成物,其中A、C为无色气体
10、下图中的每一个方格表示有关的一种反应物或生成物,其中A、C为无色气体
 ⑴写出有关的物质化学式X: C:
E: F:
⑵写出反应①的化学方程式_____________________________________
⑶写出反应②的离子方程式_____________________________________
11、A、B、C、D为中学化学中常见的四种气体单质。在一定条件下,B可以分别和ACD化合生成甲、乙、丙,C和D化合生成化合物丁。已知甲、乙、丙的每个分子中含有的电子数相等,并且甲、乙、丙、丁有入如下图所示关系:
⑴写出有关的物质化学式X: C:
E: F:
⑵写出反应①的化学方程式_____________________________________
⑶写出反应②的离子方程式_____________________________________
11、A、B、C、D为中学化学中常见的四种气体单质。在一定条件下,B可以分别和ACD化合生成甲、乙、丙,C和D化合生成化合物丁。已知甲、乙、丙的每个分子中含有的电子数相等,并且甲、乙、丙、丁有入如下图所示关系:
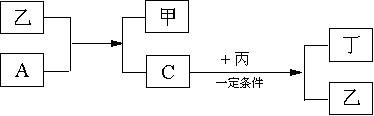 请填写下列空白:
(1)单质B的化学式是 ,电子式
。
(2)单质A和化合物乙发生反应的化学方程式是
,单质C和化合物丙发生反应的化学方程式是
。
(3)试根据化合物丙、丁中D元素的化合价,判断丙与丁能否在一定条件下发生化学反应生成D单质。若认为能反应,写出反应的化学方程式,若认为不能反应,简要说明理由。能否:
;反应方程式或理由
。
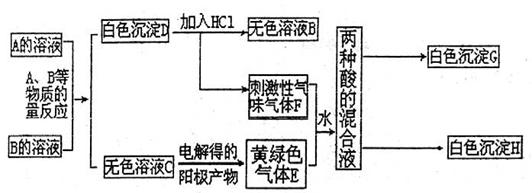
12、某无色溶液,其中可能存在如下离子:Na+、Ag+、Ba2+、Al3+、AlO2―、S2―、CO32―、SO32―、SO42―,现取该溶液进行有关实验,结果与下图所示。
请填写下列空白:
(1)单质B的化学式是 ,电子式
。
(2)单质A和化合物乙发生反应的化学方程式是
,单质C和化合物丙发生反应的化学方程式是
。
(3)试根据化合物丙、丁中D元素的化合价,判断丙与丁能否在一定条件下发生化学反应生成D单质。若认为能反应,写出反应的化学方程式,若认为不能反应,简要说明理由。能否:
;反应方程式或理由
。
12、某无色溶液,其中可能存在如下离子:Na+、Ag+、Ba2+、Al3+、AlO2―、S2―、CO32―、SO32―、SO42―,现取该溶液进行有关实验,结果与下图所示。
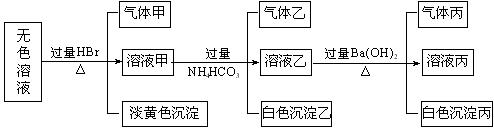 试回答下列问题:
(1)生成沉淀甲的离子方程式为
。
(2)由溶液甲生成沉淀乙的离子方程式
。
(3)沉淀丙是
。如何用一化学实验来确定其成分
。
(4)气体甲的成分有哪几种可能 。
(5)综合上述信息,可以肯定存在的离子有
,一定不存在的离子是
,可能存在的离子是 。
13、已知:A、B、E为固体化合物;D、G为固体单质;F、X、Z为可燃性气体,且F、X燃烧的火焰呈蓝色或淡蓝色。在一定条件下它们能实现如图所示的变化。
试回答下列问题:
(1)生成沉淀甲的离子方程式为
。
(2)由溶液甲生成沉淀乙的离子方程式
。
(3)沉淀丙是
。如何用一化学实验来确定其成分
。
(4)气体甲的成分有哪几种可能 。
(5)综合上述信息,可以肯定存在的离子有
,一定不存在的离子是
,可能存在的离子是 。
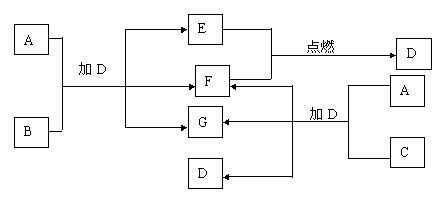
13、已知:A、B、E为固体化合物;D、G为固体单质;F、X、Z为可燃性气体,且F、X燃烧的火焰呈蓝色或淡蓝色。在一定条件下它们能实现如图所示的变化。
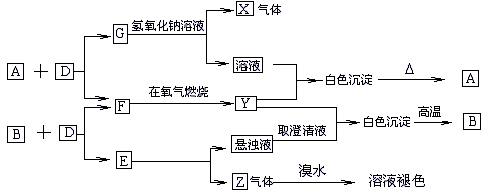 (1)写出A、B、Z、的名称。A_________,B________,E____________。
(2)G跟氢氧化钠溶液反应生成气体X和溶液,写出Y跟这种溶液所发生反应的类型______________________。
(2)写出G和氢氧化钠溶液反应的化学方程式_______________________。
(3)写出1molZ跟1molHCl反应的化学方程式________________________。
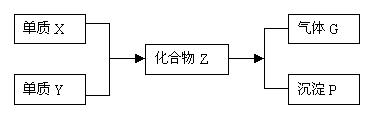
14、在一定条件下,单质X和单质Y反应,生成化合物Z,Z与水作用可生成气体G和白色沉淀P(如下框图所示),已知气体G与空气之密度比约为1.17
请填空:⑴ 组成单质X和Y的元素分别属第 族和第
族。 ⑵ 化合物Z的化学式为
。 ⑶ 每生成1mol的气体G,同时应得到
mol的沉淀P。
(1)写出A、B、Z、的名称。A_________,B________,E____________。
(2)G跟氢氧化钠溶液反应生成气体X和溶液,写出Y跟这种溶液所发生反应的类型______________________。
(2)写出G和氢氧化钠溶液反应的化学方程式_______________________。
(3)写出1molZ跟1molHCl反应的化学方程式________________________。
14、在一定条件下,单质X和单质Y反应,生成化合物Z,Z与水作用可生成气体G和白色沉淀P(如下框图所示),已知气体G与空气之密度比约为1.17
请填空:⑴ 组成单质X和Y的元素分别属第 族和第
族。 ⑵ 化合物Z的化学式为
。 ⑶ 每生成1mol的气体G,同时应得到
mol的沉淀P。
 15、下图每一字母代一种反应物或生成物。已知在常温下A是固体,B、C、E、F、G均为气态化合物,X为气态单质。根据下列反应框图填空(有些反应条件已略去)。
15、下图每一字母代一种反应物或生成物。已知在常温下A是固体,B、C、E、F、G均为气态化合物,X为气态单质。根据下列反应框图填空(有些反应条件已略去)。
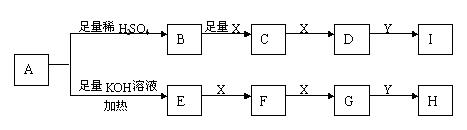 (1)A物质的名称为
。
(2)当Y是 ,则I和H溶液中溶质属于(填酸、碱、盐、氧化物) 类。
(3)写出发生下列转化的化学方程式
B→C
E→F
(4)写出E与F在一定条件下反应,且生成物中有一种单质产生的化学方程式
16、A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体,E、F、G、H、I为五种化合物,F不溶于水,E为气体且极易溶于水成为无色溶液,g溶于水得棕黄色溶液。这九种物质间反应的转化关系如下图所示。
(1)A物质的名称为
。
(2)当Y是 ,则I和H溶液中溶质属于(填酸、碱、盐、氧化物) 类。
(3)写出发生下列转化的化学方程式
B→C
E→F
(4)写出E与F在一定条件下反应,且生成物中有一种单质产生的化学方程式
16、A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体,E、F、G、H、I为五种化合物,F不溶于水,E为气体且极易溶于水成为无色溶液,g溶于水得棕黄色溶液。这九种物质间反应的转化关系如下图所示。
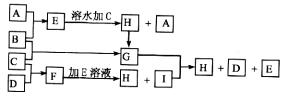 (1)写出四种单质的化学式:A ,B ,C ,D 。
(2)写出E + F→H + I的离子方程式:
。
(3)写出G + I→H + D + E的化学方程式:
。
17、
(1)写出四种单质的化学式:A ,B ,C ,D 。
(2)写出E + F→H + I的离子方程式:
。
(3)写出G + I→H + D + E的化学方程式:
。
17、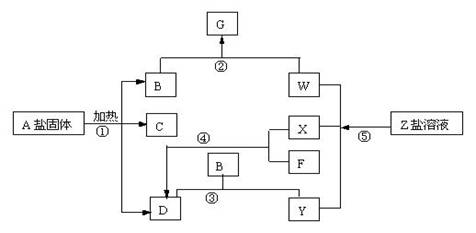 在一定条件下(不需添加另的反应物),经不同的化学反应,可实现如上图的各种变化。其中,反应③④⑤属氧化还原反应,而反应①、②属非氧化还原反应。X、F和Y为单质,且F是空气的主要成份之一,其余为化合物,据此请填空:
⑴物质A是
,F是
,X是
,Y是
。
⑵写出反应②的化学方程式:
。
⑶写出反应④的化学方程式,并注明反应条件:
。
18、在一定条件下(不需要添加别的反应物),经不同的化学反应,可实现如下图的各种反应。其中,反应③、④、⑤属氧化还原反应,而反应 ①、②属非氧化还原反应。X、F和Y为单质,且F是空气的主要组成成分之一,其余为化合物,据此请填空:
在一定条件下(不需添加另的反应物),经不同的化学反应,可实现如上图的各种变化。其中,反应③④⑤属氧化还原反应,而反应①、②属非氧化还原反应。X、F和Y为单质,且F是空气的主要成份之一,其余为化合物,据此请填空:
⑴物质A是
,F是
,X是
,Y是
。
⑵写出反应②的化学方程式:
。
⑶写出反应④的化学方程式,并注明反应条件:
。
18、在一定条件下(不需要添加别的反应物),经不同的化学反应,可实现如下图的各种反应。其中,反应③、④、⑤属氧化还原反应,而反应 ①、②属非氧化还原反应。X、F和Y为单质,且F是空气的主要组成成分之一,其余为化合物,据此请填空:
 (1)物质A是 ,F是
,X是
,Y是
。
(2)写出反应②的化学方程式
。
(3)写出反应④的化学方程式,并注明反应条件
。
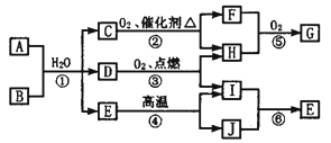
19、气体 A只含 X、Y两种短周期元素,X的原子序数大于 Y的原子序数。B、D、E是中学化学中的常见气体。固体乙是一种复杂的化合物,是具有磁性的黑色晶体;F是目前用途最广、用量最大的金属单质,F与C在高温下发生反应生成Z和固体乙。各物质有如下图所示的转化关系。
(1)物质A是 ,F是
,X是
,Y是
。
(2)写出反应②的化学方程式
。
(3)写出反应④的化学方程式,并注明反应条件
。
19、气体 A只含 X、Y两种短周期元素,X的原子序数大于 Y的原子序数。B、D、E是中学化学中的常见气体。固体乙是一种复杂的化合物,是具有磁性的黑色晶体;F是目前用途最广、用量最大的金属单质,F与C在高温下发生反应生成Z和固体乙。各物质有如下图所示的转化关系。
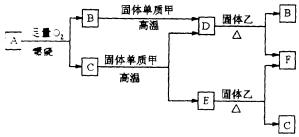 试回答下列问题:
(1)若气体A中,X与Y的质量比小于3,则气体A中肯定有(写化学式)__________。
(2)若气体A的分子为线型结构,且X与Y两元素的质量比数值上等于X的相对原子质量,则X元素位于周期表________周期,________族,A的电子式为_______________。
(3)写出下列反应的化学方程式(是离子反应的,写离子方程式):
在高温下,C与固体甲反应_________________________________________________,
在高温下,F与C反应
____________________________________________________,
F与足量稀HNO3反应
____________________________________________。
20、A、B广泛存在于自然界中,是构成岩石的主要成分。X、Y、Z都是无色可燃性气体。它们在一定条件下能实现下图所示变化:
试回答下列问题:
(1)若气体A中,X与Y的质量比小于3,则气体A中肯定有(写化学式)__________。
(2)若气体A的分子为线型结构,且X与Y两元素的质量比数值上等于X的相对原子质量,则X元素位于周期表________周期,________族,A的电子式为_______________。
(3)写出下列反应的化学方程式(是离子反应的,写离子方程式):
在高温下,C与固体甲反应_________________________________________________,
在高温下,F与C反应
____________________________________________________,
F与足量稀HNO3反应
____________________________________________。
20、A、B广泛存在于自然界中,是构成岩石的主要成分。X、Y、Z都是无色可燃性气体。它们在一定条件下能实现下图所示变化: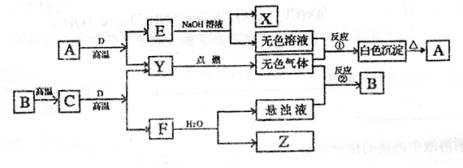 (1)如果Z是能使溴水褪色的有机化合物,则X为
,Y为
,Z
(填写化学式)。
(2)写出反应①和②的离子方程式。
反应:①
反应:②
21、有A、B、C、D四种单质,在一定条件下,A、B、C分别跟D发生化合反应相应生成甲、乙、丙(甲、乙、丙每个分子中都含有10个电子)而B跟C发生化合反应生成丁,这些单质和化合物之间发生如下反应关系:
(1)如果Z是能使溴水褪色的有机化合物,则X为
,Y为
,Z
(填写化学式)。
(2)写出反应①和②的离子方程式。
反应:①
反应:②
21、有A、B、C、D四种单质,在一定条件下,A、B、C分别跟D发生化合反应相应生成甲、乙、丙(甲、乙、丙每个分子中都含有10个电子)而B跟C发生化合反应生成丁,这些单质和化合物之间发生如下反应关系:
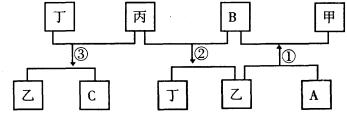 (1)写出下列物质的化学式
甲______________乙___________丙_____________丁_____________
(2)写出反应①②③的化学方程式
①____________________________________
②_________________________________________
③_________________________________________________________。
22、在一定条件下可实现下图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其它字母表示化合物。
(1)写出下列物质的化学式
甲______________乙___________丙_____________丁_____________
(2)写出反应①②③的化学方程式
①____________________________________
②_________________________________________
③_________________________________________________________。
22、在一定条件下可实现下图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其它字母表示化合物。
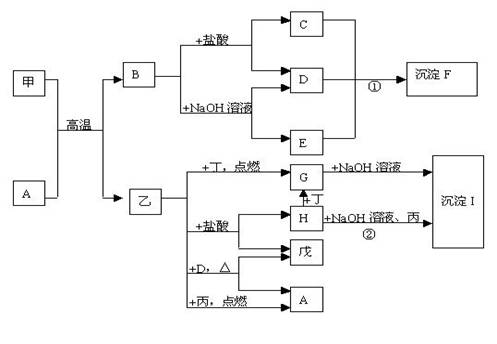 请填写下列空白:
(1)物质A的化学式是
,甲的原子结构示意图是
,
丁的电子式是
。
(2)反应①的离子方程式是
。
(3)反应②的化学方程式是
。
23、已知甲、乙、丙是三种常见的单质,且组成它们的三种元素的核电荷数之和为35,A到H是八种常见化合物。上述各物质间的相互关系见下图所示(反应条件省略):
请填写下列空白:
(1)物质A的化学式是
,甲的原子结构示意图是
,
丁的电子式是
。
(2)反应①的离子方程式是
。
(3)反应②的化学方程式是
。
23、已知甲、乙、丙是三种常见的单质,且组成它们的三种元素的核电荷数之和为35,A到H是八种常见化合物。上述各物质间的相互关系见下图所示(反应条件省略):
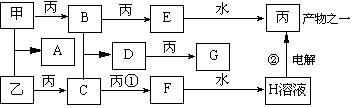 试回答:
(1)丙的化学式是__________________
(2)用电子式表示A的形成过程_____________________
_________
(3)写出①②两步的化学方程式:
①________________________________________
__
②___________________________________
_______
24、已知:下图中的物质均为中学化学中常见物质;常温下,A、C、F、H、J、K为固体,D、G为气体;A为常见金属单质;B为重要的工业原料,可用于制备炸药,其浓溶液通常呈黄色;E的溶液呈黄色;C、D均为由两种短周期元素组成的化合物;G为动植物生命活动中不可缺少的物质;方框中字母代表反应物或生成物(部分生成物已略去)。
试填空:
试回答:
(1)丙的化学式是__________________
(2)用电子式表示A的形成过程_____________________
_________
(3)写出①②两步的化学方程式:
①________________________________________
__
②___________________________________
_______
24、已知:下图中的物质均为中学化学中常见物质;常温下,A、C、F、H、J、K为固体,D、G为气体;A为常见金属单质;B为重要的工业原料,可用于制备炸药,其浓溶液通常呈黄色;E的溶液呈黄色;C、D均为由两种短周期元素组成的化合物;G为动植物生命活动中不可缺少的物质;方框中字母代表反应物或生成物(部分生成物已略去)。
试填空: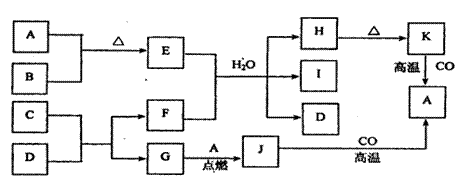 (1)B的名称 ;A在周期表中的位置
。
(2)写出化学反应方程式:C+D→F+G:
。
离子反应方程式:E+F→ H+I+D:
。
25、如图是常见物质的反应关系,其中部分产物被略去,常温下X是固体,B和G是液体,其余为气体。
(1)B的名称 ;A在周期表中的位置
。
(2)写出化学反应方程式:C+D→F+G:
。
离子反应方程式:E+F→ H+I+D:
。
25、如图是常见物质的反应关系,其中部分产物被略去,常温下X是固体,B和G是液体,其余为气体。 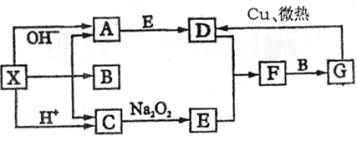 根据图中关系;
(1)推断下列物质的化学式:X
,F
。
(2)写出A→D反应的化学方程式
。
(3)写出C→E反应的化学方程式
。
26、饱和盐溶液W的电解产物发生下列的系列反应。图中的每一方格表示有关的一种主要反应物或生成物(反应中加入或生成的水以及生成的其他产物已略去)。其中A、B、C、D、E在常温常压下均是气态物质。
根据图中关系;
(1)推断下列物质的化学式:X
,F
。
(2)写出A→D反应的化学方程式
。
(3)写出C→E反应的化学方程式
。
26、饱和盐溶液W的电解产物发生下列的系列反应。图中的每一方格表示有关的一种主要反应物或生成物(反应中加入或生成的水以及生成的其他产物已略去)。其中A、B、C、D、E在常温常压下均是气态物质。
 按照反应过程,分析下列问题。 (1)确定物质化学式:W
、C
。
(2)书写饱和盐溶液W的电解化学方程式:
。
(3)书写反应①②的化学方程式,若是氧化还原反应,标出电子转移的方向的数目:
①
、②
。(4)书写反应③的离子方程式:③
。
(5)物质I是一种离子化合物,用电子式表示其结构:
。
27、已知与外加电源正极相连的电极为电解池的阳极,与外加电源负极相连的电极为电解池的阴极,在以石墨为电极电解时,电解质溶液中的阴离子在阳极发生氧化反应,电解质溶液中的阳离子在阴极发生还原反应,又知阳离子得电子的能力与其对应金属的金属活动性顺序相反(注意:Fe3+>Cu2+>Fe2+ ),阴离子失电子的能力为S2->I->Br->Cl->OH->含氧酸根离子>F-。如图所示:以石墨为电极电解A的水溶液,并做下面一系列实验,试根据实验现象完成下列问题。电解质A的水溶液焰色反应呈浅紫色。
按照反应过程,分析下列问题。 (1)确定物质化学式:W
、C
。
(2)书写饱和盐溶液W的电解化学方程式:
。
(3)书写反应①②的化学方程式,若是氧化还原反应,标出电子转移的方向的数目:
①
、②
。(4)书写反应③的离子方程式:③
。
(5)物质I是一种离子化合物,用电子式表示其结构:
。
27、已知与外加电源正极相连的电极为电解池的阳极,与外加电源负极相连的电极为电解池的阴极,在以石墨为电极电解时,电解质溶液中的阴离子在阳极发生氧化反应,电解质溶液中的阳离子在阴极发生还原反应,又知阳离子得电子的能力与其对应金属的金属活动性顺序相反(注意:Fe3+>Cu2+>Fe2+ ),阴离子失电子的能力为S2->I->Br->Cl->OH->含氧酸根离子>F-。如图所示:以石墨为电极电解A的水溶液,并做下面一系列实验,试根据实验现象完成下列问题。电解质A的水溶液焰色反应呈浅紫色。
 (1)、写出A的化学式为 ,E的名称为 。
(2)、I与F作用的离子方程式是
(3)、G加入L后产生的白色沉淀到生成红褐色沉淀H的化学方程式:
(4)、用两个最直接的离子方程式来证明Fe3+、Cu2+、Fe2+的氧化性强弱顺序是Fe3+>Cu2+>Fe2+ ①、
②、
28、A、B、C、D是中学化学中四种常见的非金属单质,在标准状况下,它们之中有三种呈气态,只有一种呈固态。B的相对分子质量很小。甲、乙、丙、X、Y五种物质都是化合物,这些化合物和A、B、C、D之间有如图所示关系:
(1)、写出A的化学式为 ,E的名称为 。
(2)、I与F作用的离子方程式是
(3)、G加入L后产生的白色沉淀到生成红褐色沉淀H的化学方程式:
(4)、用两个最直接的离子方程式来证明Fe3+、Cu2+、Fe2+的氧化性强弱顺序是Fe3+>Cu2+>Fe2+ ①、
②、
28、A、B、C、D是中学化学中四种常见的非金属单质,在标准状况下,它们之中有三种呈气态,只有一种呈固态。B的相对分子质量很小。甲、乙、丙、X、Y五种物质都是化合物,这些化合物和A、B、C、D之间有如图所示关系: 且知以上物质的所有组成元素均为短周期元素。根据以上事实,回答下列问题:
(1)化合物乙与氢氧化钠按物质的量之比1:3恰好完全反应,则乙的化学式是 。
(2)图中的化学反应共有
个化合反应,
个氧化还原反应。
(3)Y与甲反应生成乙和丙的化学方程式为:
。
29、
且知以上物质的所有组成元素均为短周期元素。根据以上事实,回答下列问题:
(1)化合物乙与氢氧化钠按物质的量之比1:3恰好完全反应,则乙的化学式是 。
(2)图中的化学反应共有
个化合反应,
个氧化还原反应。
(3)Y与甲反应生成乙和丙的化学方程式为:
。
29、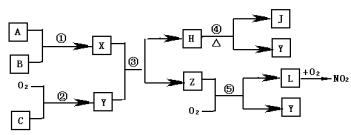 A、B、C、是单质,X、Y、Z、H、J、L是化合物,组成B的元素是绿色植物生活所必需的微量元素之一,且B在空气中燃烧可以得到X和J,X和J均为固体,X水
解可生成两种碱性物质。在适当条件下,它们相互之间有下图所所示的转化关系:
(1)用化学式表示化合物L
单质C
。
(2)物质Z的分子空间构型是
。
(3)反应①的化学方程式
。
(4)反应⑤的化学方程式
。
(5)在常温下用气体密度测定NO2的相对分子质量,实验值比理论纸值偏 (填“高”或“低”),其原因是 。
30、A、B两种盐均为无色晶体,其中A的焰色反应呈紫色(透过蓝色钴玻璃),A的水溶液pH值大于7。下面是A、B两种盐所进行的实验记录,其中H、G均为不溶于硝酸的白色沉淀,气体E、F均可使品红溶液褪色。
A、B、C、是单质,X、Y、Z、H、J、L是化合物,组成B的元素是绿色植物生活所必需的微量元素之一,且B在空气中燃烧可以得到X和J,X和J均为固体,X水
解可生成两种碱性物质。在适当条件下,它们相互之间有下图所所示的转化关系:
(1)用化学式表示化合物L
单质C
。
(2)物质Z的分子空间构型是
。
(3)反应①的化学方程式
。
(4)反应⑤的化学方程式
。
(5)在常温下用气体密度测定NO2的相对分子质量,实验值比理论纸值偏 (填“高”或“低”),其原因是 。
30、A、B两种盐均为无色晶体,其中A的焰色反应呈紫色(透过蓝色钴玻璃),A的水溶液pH值大于7。下面是A、B两种盐所进行的实验记录,其中H、G均为不溶于硝酸的白色沉淀,气体E、F均可使品红溶液褪色。
 (1)写出A、B两种物质的化学式A
B
(2)写出E、F两物质反应的离子方程
。
(3)请写出将少量气体E通入过量的FeBr2溶液时发生的离子反应方程式(要求用双线桥法表示出电子转移的方向和数目)
。
(4)请写出物质C的电子式
。
(5)请写出电解C的无色溶液的化学方程式
。
31、已知A-G是中学化学中常见的7种物质,所有物质均由短周期元素组成,其中B、C、G都含有同一种元素,B、E、F都为单质。常温、常压下D为液体,E、F为气体,F是空气的主要成分之一。C由2种元素组成,其晶体熔点高、硬度大,闪烁着晶莹的光泽。A-C可以发生如下转化,其反应的关系如下图所示。请填写下列空白。
(1)写出A、B两种物质的化学式A
B
(2)写出E、F两物质反应的离子方程
。
(3)请写出将少量气体E通入过量的FeBr2溶液时发生的离子反应方程式(要求用双线桥法表示出电子转移的方向和数目)
。
(4)请写出物质C的电子式
。
(5)请写出电解C的无色溶液的化学方程式
。
31、已知A-G是中学化学中常见的7种物质,所有物质均由短周期元素组成,其中B、C、G都含有同一种元素,B、E、F都为单质。常温、常压下D为液体,E、F为气体,F是空气的主要成分之一。C由2种元素组成,其晶体熔点高、硬度大,闪烁着晶莹的光泽。A-C可以发生如下转化,其反应的关系如下图所示。请填写下列空白。
 (1)写出E+F→D的化学反应方程式:
;
(2)B的化学式是
;
(3)如图所示A与C两种固体混合后,加入液体D,可能发生反应的化学方程式为
。
32、下图每一方框中的字母代表一种反应物或生成物:
(1)写出E+F→D的化学反应方程式:
;
(2)B的化学式是
;
(3)如图所示A与C两种固体混合后,加入液体D,可能发生反应的化学方程式为
。
32、下图每一方框中的字母代表一种反应物或生成物: 
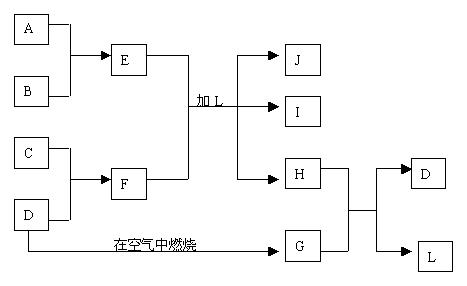 产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:
(1)L的化学式为: 。(2)F的化学式为:
。
(3)写出J受热分解反应的化学方程式:
。
(4)H和G之间反应的化学方程式为:
。
33、A、B、C、D分别是硝酸钡、氨水、氢氧化钠和碳酸氢钠四种溶液中的一种。现利用另一种溶液X,用如下图所示的方法,即可将它们一一确定。
产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:
(1)L的化学式为: 。(2)F的化学式为:
。
(3)写出J受热分解反应的化学方程式:
。
(4)H和G之间反应的化学方程式为:
。
33、A、B、C、D分别是硝酸钡、氨水、氢氧化钠和碳酸氢钠四种溶液中的一种。现利用另一种溶液X,用如下图所示的方法,即可将它们一一确定。
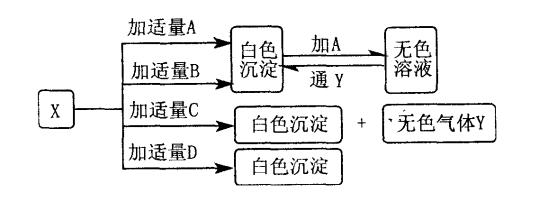 请写出:
(1)化学式A
,B
,C
,D
,X
。
(2)无色气体Y的电子式
。
(3)X与C反应的离子方程式
。
34、已知A、B、C均为常见的单质,其中A为金属,B、C为非金属,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略)。
请写出:
(1)化学式A
,B
,C
,D
,X
。
(2)无色气体Y的电子式
。
(3)X与C反应的离子方程式
。
34、已知A、B、C均为常见的单质,其中A为金属,B、C为非金属,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略)。
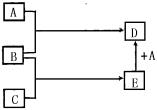 请回答:
(1)若常温下B、C均为气体,D为黑色晶体,E的电子式为
,A和E在
一定条件下反应生成D的化学方程式为
。
(2)若常温下B为气体,C为黑色固体,则构成金属A的原子结构示意图为
,E的结构式为
,A和E在一定条件下反应生成D的化学方程式为
。
35、下图为中学化学中一些常见物质间发生的一系列转化的框图(反应所需和产生的水及某些反应条件已略去)。
请回答:
(1)若常温下B、C均为气体,D为黑色晶体,E的电子式为
,A和E在
一定条件下反应生成D的化学方程式为
。
(2)若常温下B为气体,C为黑色固体,则构成金属A的原子结构示意图为
,E的结构式为
,A和E在一定条件下反应生成D的化学方程式为
。
35、下图为中学化学中一些常见物质间发生的一系列转化的框图(反应所需和产生的水及某些反应条件已略去)。
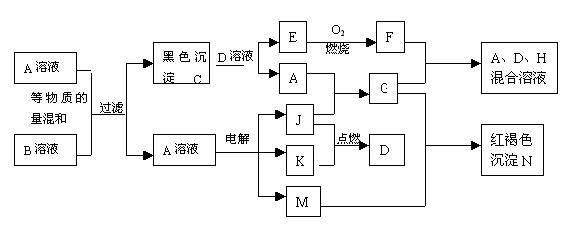
 其中I溶液的电解反应是工业生产中的一种重要的无机化工生产反应;J、K为气体单质;D、E、F为气态化合物。
(1)写出下列物质的化学式A: ;B:
;E:
;N:
。
(2)写出下列反应的离子方程式:
①C+D:
。
②F+G:
。
③M+G:
。
36、根据下面框图填空。已知:物质A的焰色反应呈黄色;物质G是一种白色物质,微溶于水;D、E为两种气体单质;M是一种合成树脂,常用于制备塑料和合成纤维。
其中I溶液的电解反应是工业生产中的一种重要的无机化工生产反应;J、K为气体单质;D、E、F为气态化合物。
(1)写出下列物质的化学式A: ;B:
;E:
;N:
。
(2)写出下列反应的离子方程式:
①C+D:
。
②F+G:
。
③M+G:
。
36、根据下面框图填空。已知:物质A的焰色反应呈黄色;物质G是一种白色物质,微溶于水;D、E为两种气体单质;M是一种合成树脂,常用于制备塑料和合成纤维。
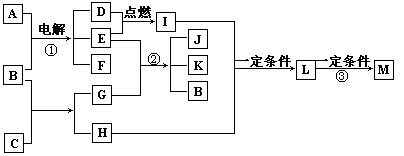 回答:
(1)物质C的电子式____________________
(2)写出反应的化学方程式。
反应①_______________________________________
反应②_______________________________________
反应③_______________________________________
37、物质M、N、A、B、C、D、E、F、G、H,其中C、H为常见金属,且混合气体A在常温下不与空气接触时能发生如图所示变化(其他有关反应条件均略去):
回答:
(1)物质C的电子式____________________
(2)写出反应的化学方程式。
反应①_______________________________________
反应②_______________________________________
反应③_______________________________________
37、物质M、N、A、B、C、D、E、F、G、H,其中C、H为常见金属,且混合气体A在常温下不与空气接触时能发生如图所示变化(其他有关反应条件均略去):
 试回答:
(1)写出C、D和H的化学式:
C:
;D:
;H:
。
(2)写出反应①②③的化学方程式:
①
②
③
38、气体A只含有X、Y两种短周期元素,X的原子序数大于Y的原子序数。B、D、E是中学化学中常见的气体,各物质产间有如图13所示的转化关系:
试回答:
(1)写出C、D和H的化学式:
C:
;D:
;H:
。
(2)写出反应①②③的化学方程式:
①
②
③
38、气体A只含有X、Y两种短周期元素,X的原子序数大于Y的原子序数。B、D、E是中学化学中常见的气体,各物质产间有如图13所示的转化关系:
 请回答下列问题:
请回答下列问题: (1)若气体A中,X、Y两种元素的质量比等于3 : 1,请写出下列物质的化学式
A ,D ,F
,乙 。
(2)若X、Y两种元素的质量比在数值上等于X的相对原子质量,且气体A的分子为直线型结构,则A的电子式为
。
(3)C与固体甲在高温时发生反应的化学方程式为
。
39、(2005济南统考)中学常见物质A-J的转化关系如下图。
(1)若气体A中,X、Y两种元素的质量比等于3 : 1,请写出下列物质的化学式
A ,D ,F
,乙 。
(2)若X、Y两种元素的质量比在数值上等于X的相对原子质量,且气体A的分子为直线型结构,则A的电子式为
。
(3)C与固体甲在高温时发生反应的化学方程式为
。
39、(2005济南统考)中学常见物质A-J的转化关系如下图。
 其中A为酸式盐,B为某二价主族金属的化合物,B在常温下可与水反应得D和碱,等物质的量A、B与适量水充分混合恰好完全反应;常温常压下,C、D均为气态;反应④和⑤分别是工业上生产化合物J和化合物G的重要方法。
其中A为酸式盐,B为某二价主族金属的化合物,B在常温下可与水反应得D和碱,等物质的量A、B与适量水充分混合恰好完全反应;常温常压下,C、D均为气态;反应④和⑤分别是工业上生产化合物J和化合物G的重要方法。 据此,请回答下列问题:
(1)C的电子为______________,B的化学式为______________。
(2)写出下列反应的化学方程式:
反应②__________________________________;
反应⑤__________________________________。
(3)A溶液与过量Ca(OH)2溶液反应的离子方程式为:__________。
(4)写出以石墨电极电解G的钠盐水溶液的电极反应式:
阴极________________________;
阳极________________________。
40、A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,甲、乙、丙为常见化合物。它们之间有如下转化关系:
据此,请回答下列问题:
(1)C的电子为______________,B的化学式为______________。
(2)写出下列反应的化学方程式:
反应②__________________________________;
反应⑤__________________________________。
(3)A溶液与过量Ca(OH)2溶液反应的离子方程式为:__________。
(4)写出以石墨电极电解G的钠盐水溶液的电极反应式:
阴极________________________;
阳极________________________。
40、A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,甲、乙、丙为常见化合物。它们之间有如下转化关系:
 回答下列问题:
(1)A的电子式
。
(2)D与甲溶液反应的化学方程式
。
(3)丙的水溶液显
性(填酸或碱),原因是(用离子方程式表示)
。
(4)一定条件下,2molB与3molD的氧化物W恰好反应,则W的化学式
。
41、(2006杭州二检)下图所涉及的物质均为中学化学中的常见物质,其中C、D、E为单质,其余为化合物。
回答下列问题:
(1)A的电子式
。
(2)D与甲溶液反应的化学方程式
。
(3)丙的水溶液显
性(填酸或碱),原因是(用离子方程式表示)
。
(4)一定条件下,2molB与3molD的氧化物W恰好反应,则W的化学式
。
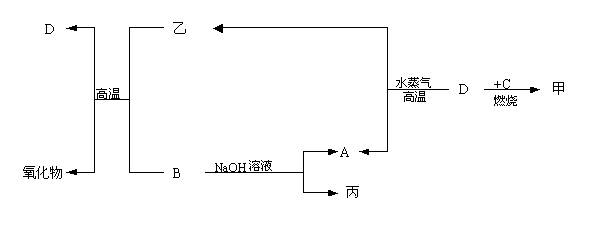
41、(2006杭州二检)下图所涉及的物质均为中学化学中的常见物质,其中C、D、E为单质,其余为化合物。
 它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写化学化式:B
、E
。
(2)指出MnO2在相关反应中的作用:反应①中是 剂,反应②中是 剂。
(3)完成F与B发生反应的化学方程式
。
(4)若反应①是在加热条件下进行,A是 ;若反应①是在常温条件下进行,A是
。若在上述两种条件下得到等量的C单质,反应中转移的电子数之比为
。
42、已知:①A、B、C、D四种为短周期元素,且原子序数依次递增.②A、B、C三种元素的核电荷数之和等于D元素的核电荷数,且D元素的核电荷数为C元素核电荷数的2倍。③C、D元素同主族,且能在一定条件下发生下面两个反应:
它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写化学化式:B
、E
。
(2)指出MnO2在相关反应中的作用:反应①中是 剂,反应②中是 剂。
(3)完成F与B发生反应的化学方程式
。
(4)若反应①是在加热条件下进行,A是 ;若反应①是在常温条件下进行,A是
。若在上述两种条件下得到等量的C单质,反应中转移的电子数之比为
。
42、已知:①A、B、C、D四种为短周期元素,且原子序数依次递增.②A、B、C三种元素的核电荷数之和等于D元素的核电荷数,且D元素的核电荷数为C元素核电荷数的2倍。③C、D元素同主族,且能在一定条件下发生下面两个反应:
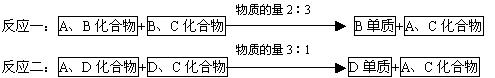 请回答:
(1)D元素最高价氧化物的水化物的化学式是 ,B单质的电子式是
,B、C原子半径大小关系为
.
(2)写出满足“反应二”的化学反应方程式
.
(3)由这四种元素组成的化合物中(四种元素都有),相同浓度下pH最小的化合物的化学式是 .
43、(2005潍坊统考)已知甲、乙、丙为常见的单质,A、B、C、D、X、Y、Z为常见化合物,且丙在常温常压下为气体,B为淡黄色固体,Y的摩尔质量数值比Z小16,乙、丙的摩尔质量相同,B的摩尔质量比D小2,B、X的摩尔质量相同。
各物质之间的转化关系如下图所示(各反应条件略)。
请回答:
(1)D元素最高价氧化物的水化物的化学式是 ,B单质的电子式是
,B、C原子半径大小关系为
.
(2)写出满足“反应二”的化学反应方程式
.
(3)由这四种元素组成的化合物中(四种元素都有),相同浓度下pH最小的化合物的化学式是 .
43、(2005潍坊统考)已知甲、乙、丙为常见的单质,A、B、C、D、X、Y、Z为常见化合物,且丙在常温常压下为气体,B为淡黄色固体,Y的摩尔质量数值比Z小16,乙、丙的摩尔质量相同,B的摩尔质量比D小2,B、X的摩尔质量相同。
各物质之间的转化关系如下图所示(各反应条件略)。
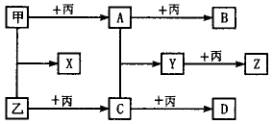 请回答:
(1)在B与二氧化碳的反应中,每有1 mol电子转移,生成气体____L(标准状况)。
(2)X与Y的溶液混合后,再加入适量盐酸,会有乙生成,反应的离子方程式是__________________________________________________。
(3)将C通入溴水中,所发生反应的化学方程式是__________;D属于______________晶体(填晶体类型)。
(4)在101 kPa时,4.0 g乙在一定条件下与丙完全反应生成C,放出37 kJ的热量,该反应的热化学方程式是__________________________________________________。
(5)比甲元素的原子序数少4的M元素,在一定条件下能与氢元素组成化合物MH5。已知MH5的结构与氯化铵相似,MH5与水作用有氢气生成,则MH5的电子式为______________(M要用元素符号表示)。写出MH5与AlCl3溶液反应的化学方程式_______________________________________。
44、(2005辽宁模拟)下图表示某化工生产的流程(有的反应条件和产物已略去)
请回答:
(1)在B与二氧化碳的反应中,每有1 mol电子转移,生成气体____L(标准状况)。
(2)X与Y的溶液混合后,再加入适量盐酸,会有乙生成,反应的离子方程式是__________________________________________________。
(3)将C通入溴水中,所发生反应的化学方程式是__________;D属于______________晶体(填晶体类型)。
(4)在101 kPa时,4.0 g乙在一定条件下与丙完全反应生成C,放出37 kJ的热量,该反应的热化学方程式是__________________________________________________。
(5)比甲元素的原子序数少4的M元素,在一定条件下能与氢元素组成化合物MH5。已知MH5的结构与氯化铵相似,MH5与水作用有氢气生成,则MH5的电子式为______________(M要用元素符号表示)。写出MH5与AlCl3溶液反应的化学方程式_______________________________________。
44、(2005辽宁模拟)下图表示某化工生产的流程(有的反应条件和产物已略去)
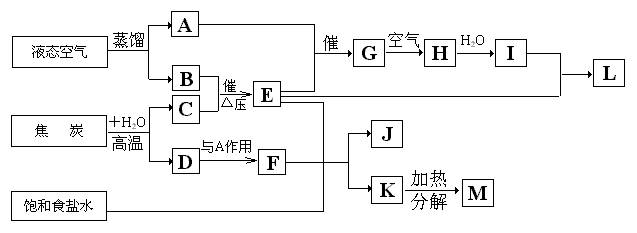 试回答:
(1)、C的分子式是
,L的名称是
。
(2)、写出A与E反应生成G的化学方程式:
(3)、G到H的反应中,氧化剂与还原剂的物质的量之比为
(4)、写出饱和食盐水与F和E反应生成J和K的化学方程式:
(5)、写出由上述流程图中出现的元素组成的五种铵盐的化学式:
试回答:
(1)、C的分子式是
,L的名称是
。
(2)、写出A与E反应生成G的化学方程式:
(3)、G到H的反应中,氧化剂与还原剂的物质的量之比为
(4)、写出饱和食盐水与F和E反应生成J和K的化学方程式:
(5)、写出由上述流程图中出现的元素组成的五种铵盐的化学式:

《无机框图推断题》参考答案
33、(8分)获得2008年度国家最高科技奖的徐光宪教授在中国化学会第7次全国会员代表大会上作的题为“21世纪是信息科学、合成化学和生命科学共同繁荣的世纪”的报告指出:在20世纪的七大发明中,人类最迫切需要的、对人们的生活和世界经济的发展影响最大的两大发明是信息技术和合成化学技术。下图表示的是某质子交换膜的合成方法,部分反应条件未列出。
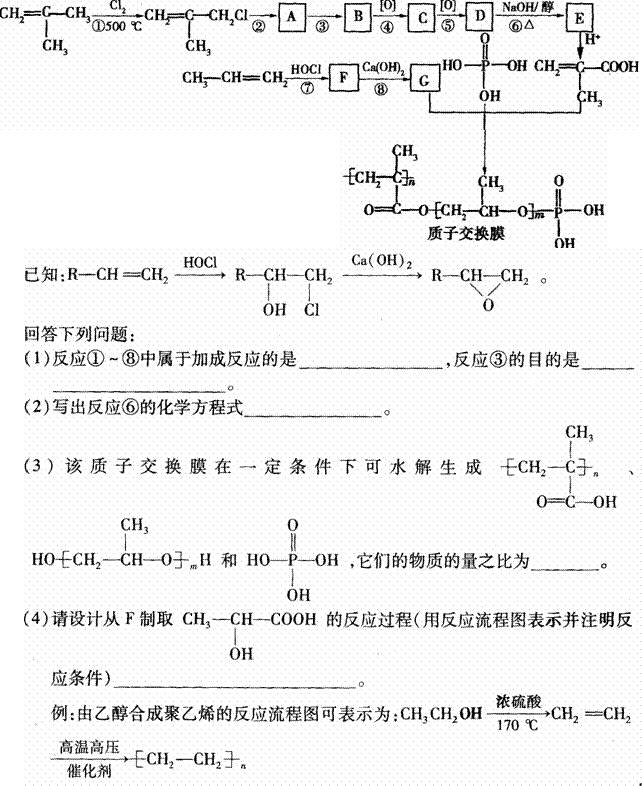
32.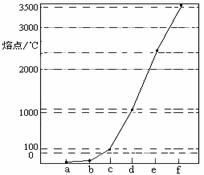 (8分)右图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
(8分)右图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
(1)请写出上图中b单质对应元素原子的电子排布式_______。
(2)单质a、f对应的元素以原子个数比1 :1形成的分子(相同条件下对H2的相对密度为13)中含 个 键 和 个
键 和 个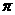 键。
键。
 (3)a与b的元素形成的10电子中性分子X的空间构型为
; 将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为
,其中X与Ag+之间以
键结合。
(3)a与b的元素形成的10电子中性分子X的空间构型为
; 将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为
,其中X与Ag+之间以
键结合。
(4)右图是上述六种元素中的一种元素形成的含氧酸的结构:
请简要说明该物质易溶于水的原因___________________________________
_______________________________________________________________。
30. (13分)下图所示物质转化中,常温下E为无色、无味的液体,F为淡黄色粉末,G为无色气体(反应条件均已省略)。
(13分)下图所示物质转化中,常温下E为无色、无味的液体,F为淡黄色粉末,G为无色气体(反应条件均已省略)。
回答下列问题:
(1)在反应②中,每生成2.24 L气体G(标准状况下)时,该反应转移电子的物质的量是____________。
(2)若反应①在加热条件下进行,且C、D是两种均能使澄清石灰水变浑浊的无色气体.
则反应①的化学方程式是_______________________________。
(3)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素构成。则A过量时反应①的化学方程式是_____________
___________________。
(4)若反应①在溶液中进行,A是一种强碱,B是一种酸式盐,D是一种气体,且B遇盐酸有气体产生。在加热条件下,当A过量时反应①的离子方程式是_____________________
__________________________。实验室制取气体D的化学方程式_____________________。
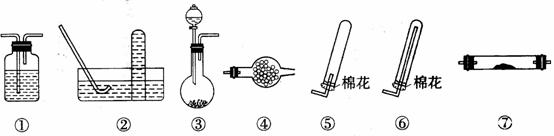
(5)在实验室中用下列装置(固定、加热仪器和橡胶管略)进行有关气体的制取实验探究。请回答下列问题:
Ⅰ.气体制备时需检查装置的气密性,如下图所示各装置,肯定不符合气密性检查要求的是____________。
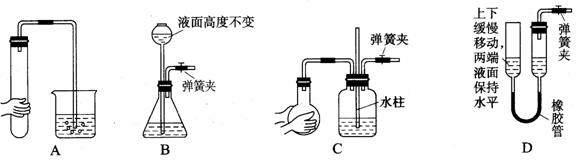
Ⅱ.若用装置③制取并收集干燥的NH3,烧瓶内装的试剂是 。收集装置应选择 (填装置序号)。证明氨气已收集满的操作是
。
29.(15分)短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外层数之和为10;B的化合物种类繁多,数目庞大。C、D是空气中含量最多的两种元素;D、E两单质可以生成两种不同的离子化合物。
(1)写出E的单质与A、D两元素形成的常见化合物反应的离子方程式 ___________
___ _。
(2)由A、C、D三元素所形成的共含有9个原子的常见化合物的溶液呈_________性(填“酸”、“中”、“碱”),该溶液中离子浓度大小的排列顺序是 ______________________。
(3)B的相对分子质量最小的氢化物的燃烧热为890.3 kJ·mol-1,写出其燃烧的热化学方程式___________________________________________________________。
 该氢化物与D的单质在碱性介质中可以形成燃料电池,写出该燃料电池的负极上发生反应的电极反应式____________________。
该氢化物与D的单质在碱性介质中可以形成燃料电池,写出该燃料电池的负极上发生反应的电极反应式____________________。
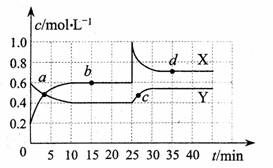
(4)X、Y是均由C、D两元素组成的化合物,且C、D在X、Y中的价态相同,某温度下相互转化时的量变关系如右图:
X的化学式是______________,
图中a、b、c、d四点中,表示反应υ正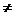 υ逆 的是 ________,
υ逆 的是 ________,
该温度下,反应Y转化为X的平衡常数为_____________,
反应进行到25min时,改变的条件可能是______________。
(5)现有由A、B、D、E四种元素中的三种组成的0.1mol·L-1某正盐溶液, 你认为该溶液呈碱性的原因是(用离子方程式表示):___________________________;为证明你的上述观点,请设计一个简单的实验,简述实验过程:___________________________。
某同学认为该正盐溶液中的水解是微弱的,发生水解的BD32-离子不超过其总量的10%。请你设计实验证明该同学的观点是否正确______________________________________。
28.(14分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜反应的情况,回答下列问题:
 (1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反应的化学方程式为____________________________________。
(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反应的化学方程式为____________________________________。
某同学未加入氧化剂,而是设计了一个实验装置,也能 使铜很快溶于稀盐酸。请在方格中画出该装置。
(2)在一定体积的18mol·L-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9mol,则该硫酸的实际体积 (填“大于”、“等于”或“小于”)100mL。
有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗? (填“可行”或“不可行”)如果可行,用离子方程式说明原因;如果不可行,此空可以不填 ____________________________________。
(3)将等质量的铜片分别与等体积、过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出可能是Cu2+浓度不同引起的,你同意这种看法吗? (填“同意”或“不同意”),原因是 ___________________ 。
另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否,简述实验方案、实验现象及由此得出的结论:___________________________
_ __。
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol ·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是______________mL。
15. 已知25℃时有关弱酸的电离平衡常数:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
则下列有关说法正确的是( )
A、等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B、a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
C、冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
D、NaHCO3和Na2CO3等物质的量混合溶液中,一定存在:
c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
14.我国著名化学家徐光宪因在稀土元素研究领域作出突出贡献荣获2008年“国家最高科学技术奖”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
A.电解熔融CeO2制Ce,铈在阳极获得
B.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑
C.用Ce(S04)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
D.四种稳定的核素136 58Ce、138 58Ce、140 58Ce、142 58Ce,它们互称为同位素
13.下列离子方程式表达正确的是
A.铜片加入稀硝酸中:Cu+NO3-+4H+=Cu2++NO↑+2H2O
B.Ca(HCO3)2溶液与Ca(OH)2溶液任意比混合:Ca2++HCO3-+OH-=CaCO3↓+H2O
C. 硫酸氢钠溶液中逐滴加入氢氧化钡溶液,至溶液恰好呈中性:
Ba2++OH-+SO42-+H+=BaSO4↓+H2O
D.少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com