
题目列表(包括答案和解析)
14. 某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a ,将其全部投入50mLbmol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a ,将其全部投入50mLbmol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
 A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
 B.若金属全部溶解,则溶液中一定含有Fe3+
B.若金属全部溶解,则溶液中一定含有Fe3+
 C.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3
C.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3
 D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
 第Ⅱ卷 (非选择题,共72分)
第Ⅱ卷 (非选择题,共72分)
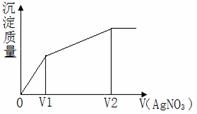
13. 往含I-和Cl-的稀溶液中滴人AgNO3溶液,沉淀的质量(不同时产生两种沉淀)与加入AgNO3溶液体积的关系如上图(第13题图)所示。则原溶液中c(I-)/c(Cl-)的比值为
往含I-和Cl-的稀溶液中滴人AgNO3溶液,沉淀的质量(不同时产生两种沉淀)与加入AgNO3溶液体积的关系如上图(第13题图)所示。则原溶液中c(I-)/c(Cl-)的比值为
 A. (V2-V1)/V1 B. V1/V2 C. V1/(V2-V1) D. V2/V1
A. (V2-V1)/V1 B. V1/V2 C. V1/(V2-V1) D. V2/V1
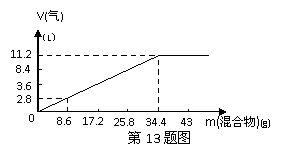
12. 在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4固体混合物,加热充分反应,加入的混合物的质量和产生的气体的体积(标准状况)关系如下图(第12题图)。当V(NaOH)=140mL时,固体混合物的质量是51.6g,充分反应后,生成气体的体积是(标准状况)
在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4固体混合物,加热充分反应,加入的混合物的质量和产生的气体的体积(标准状况)关系如下图(第12题图)。当V(NaOH)=140mL时,固体混合物的质量是51.6g,充分反应后,生成气体的体积是(标准状况)
 A. 7.84L剂
B. 8.4L
C.
15.68L
D. 16.8L
A. 7.84L剂
B. 8.4L
C.
15.68L
D. 16.8L

 |
|||
|
|||





11. 一刚性密闭容器内部有一不漏气且可滑动的活塞将容器分成左右两个室,左室内充入一定体积的CO和H2O气体,右室充入S02和O2两种气体,且S02和O2的物质的量之比为2:1,左右两室内各可发生如下反应:
一刚性密闭容器内部有一不漏气且可滑动的活塞将容器分成左右两个室,左室内充入一定体积的CO和H2O气体,右室充入S02和O2两种气体,且S02和O2的物质的量之比为2:1,左右两室内各可发生如下反应:
左室 CO(气)+H2O(气) 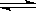 CO2(气)+H2(气)△H<0
CO2(气)+H2(气)△H<0
 右室 2S02(气)+O2(气)
右室 2S02(气)+O2(气) 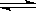 2SO3(气) △H<0
2SO3(气) △H<0
 反应开始时活塞停留在离左端点3/7处,反应在恒温下进行,当达平衡状态时,活塞处于容器中间。下列叙述正确的是
( )
反应开始时活塞停留在离左端点3/7处,反应在恒温下进行,当达平衡状态时,活塞处于容器中间。下列叙述正确的是
( )
 A. 右室气体反应前后的压强之比为4:3
A. 右室气体反应前后的压强之比为4:3
 B.反应达平衡时气体S02的转化率为75%
B.反应达平衡时气体S02的转化率为75%
 C.平衡时再向左室中充入与原物质的量之比相同的CO和H2O气体,达平衡
C.平衡时再向左室中充入与原物质的量之比相同的CO和H2O气体,达平衡
 时,CO的物质的量分数不变 ,S02的物质的量分数变小
时,CO的物质的量分数不变 ,S02的物质的量分数变小
 D.若原容器中左右两室起始时充入的各物质的量均为原来的两倍,达平衡时,
D.若原容器中左右两室起始时充入的各物质的量均为原来的两倍,达平衡时,
 活塞相对与中间位置将偏左
活塞相对与中间位置将偏左
10. 25℃时,下列各溶液中有关物质的量浓度关系正确的是
25℃时,下列各溶液中有关物质的量浓度关系正确的是
 A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:
A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:
 c(Na+) >c(CH3COO-)>c(H+)>c(OH-)
c(Na+) >c(CH3COO-)>c(H+)>c(OH-)
 B.常温下将等体积等物质的量浓度的醋酸钠与盐酸两溶液混合:
B.常温下将等体积等物质的量浓度的醋酸钠与盐酸两溶液混合:
 c(Na+) > c(CH3COOH)
>c(CH3COO-)>c(H+)>c(OH-)
c(Na+) > c(CH3COOH)
>c(CH3COO-)>c(H+)>c(OH-)
 C.向NH4HSO4溶液中滴加等物质的量的NaOH:
C.向NH4HSO4溶液中滴加等物质的量的NaOH:
 c(Na+) =c(SO42-) >c(NH4+) >c(H+) >c(OH-)
c(Na+) =c(SO42-) >c(NH4+) >c(H+) >c(OH-)
 D.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:
D.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:
 c(CH3COONa)>c(Na2CO3) >c(C6H5ONa ) >c(NaOH )
c(CH3COONa)>c(Na2CO3) >c(C6H5ONa ) >c(NaOH )
9. 下列离子方程式正确的是
下列离子方程式正确的是
 A.Fe(OH)3与氢溴酸溶液混合:Fe(OH)3+3H+=Fe3++3H2O
A.Fe(OH)3与氢溴酸溶液混合:Fe(OH)3+3H+=Fe3++3H2O
 B.1mol/L的NaAlO2溶液和2.5
mol/L的HCl等体积互相均匀混合:
B.1mol/L的NaAlO2溶液和2.5
mol/L的HCl等体积互相均匀混合:
 2AlO2-+5H+ =Al(OH)3↓+Al3++H2O
2AlO2-+5H+ =Al(OH)3↓+Al3++H2O
 C.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液
C.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液
 NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
 D.碳酸氢镁溶液中加入足量氢氧化钠:
D.碳酸氢镁溶液中加入足量氢氧化钠:
 Mg2+ + 2HCO3ˉ+ 2OHˉ= MgCO3↓+ 2H2O + CO32-
Mg2+ + 2HCO3ˉ+ 2OHˉ= MgCO3↓+ 2H2O + CO32-
8.已知某化学反应的平衡常数表达式为K=
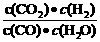 ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:

 下列有关叙述不正确的是:
下列有关叙述不正确的是:
 A.该反应的化学方程式是:CO(g)+
A.该反应的化学方程式是:CO(g)+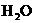 (g)
(g)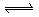
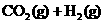
 B.上述反应的正反应是放热反应.
B.上述反应的正反应是放热反应.
 C.如果在一定体积的密闭容器中加入
C.如果在一定体积的密闭容器中加入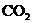 和
和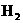 各1 mol,5 min后温度升高到830℃,此时测得
各1 mol,5 min后温度升高到830℃,此时测得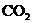 为0.4 mol时,该反应为平衡状态。
为0.4 mol时,该反应为平衡状态。
 D.某温度下,如果平衡浓度符合下列关系式:
D.某温度下,如果平衡浓度符合下列关系式: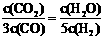 ,试判断此时的温度是1000℃.
,试判断此时的温度是1000℃.
 不定项选择题 本题包括6小题,每小题4分,共计24分。每小题有一个或二个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
不定项选择题 本题包括6小题,每小题4分,共计24分。每小题有一个或二个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
7. 被称之为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,而在其另一边喷涂二氧化锰)作为传导体。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为: Zn+2MnO2+H2O=ZnO+2MnO(OH),下列说法正确的是
被称之为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,而在其另一边喷涂二氧化锰)作为传导体。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为: Zn+2MnO2+H2O=ZnO+2MnO(OH),下列说法正确的是
 A. 该电池的负极为锌,发生还原反应
A. 该电池的负极为锌,发生还原反应
 B. 该电池反应中二氧化锰起催化剂作用
B. 该电池反应中二氧化锰起催化剂作用
 C. 当0.1 mol Zn完全溶解时,转移电子个数为1.204 ×1024
C. 当0.1 mol Zn完全溶解时,转移电子个数为1.204 ×1024
 D.
电池正极反应式为:2MnO2 +2e-十2H2O=2MnO(OH)+2OH-
D.
电池正极反应式为:2MnO2 +2e-十2H2O=2MnO(OH)+2OH-
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
1.67 |
1.11 |
1.00 |
0.60 |
0.38 |
6. 用NA表示阿伏加德罗常数的值。下列叙述正确的是
用NA表示阿伏加德罗常数的值。下列叙述正确的是

 A.在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子
A.在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子
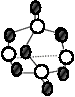
 B.17.4g某硫化磷(如图)中含P-S键数目为0.6NA
B.17.4g某硫化磷(如图)中含P-S键数目为0.6NA
 C.1mol含8个碳原子的某烃分子,最多形成8mol碳碳单键
C.1mol含8个碳原子的某烃分子,最多形成8mol碳碳单键
 D.标况下,22.4LSO2与O2混合气体,含有2NA个氧原子
D.标况下,22.4LSO2与O2混合气体,含有2NA个氧原子
5. 原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1.下列有关x的说法中不正确的是
原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1.下列有关x的说法中不正确的是
 A.X最高价氧化物对应的水化物可能显碱性
A.X最高价氧化物对应的水化物可能显碱性
 B.X可能形成化学式为KXO2的钾盐
B.X可能形成化学式为KXO2的钾盐
 C.X原子的最外层电子数和核电荷数肯定为奇数
C.X原子的最外层电子数和核电荷数肯定为奇数
 D.X能与某些金属元素形成离子化合物
D.X能与某些金属元素形成离子化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com