
题目列表(包括答案和解析)
33. [化学--有机化学基础]化合物A是一种食用香料,分子式为C11H12O3,其合成路线如下:
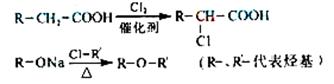
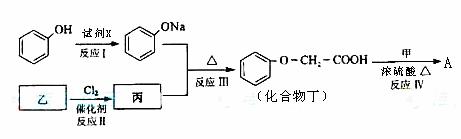
已知:
试回答:
(1)试剂X不可以选用的是(填字母) 。
a.NaOH溶液 b.Na2CO3溶液 c.NaHCO3溶液 d.Na
(2)丙的结构简式是 ,反应II的反应类型分别是 。
(3)化合物丁有多种类型的同分异构体,其中能与FeCl3溶液发生显色反应,且有两种一硝基取代物的同分异构体是(写出任意2种) 。
(4)已知化合物甲为链状结构,分子结构中不含甲基。试写出反应IV的化学方程式。
。
适应性练习(一)答案
32.[化学--物质结构与性质]目前,全世界镍(Ni)的消费量仅次于铜、铝、铅、锌,居有色金属第五位,镍行业发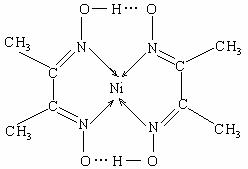 展蕴藏着巨大的潜力。
展蕴藏着巨大的潜力。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子排布式为 。
(2)某配合物结构如右图所示,分子内含有的作用力有 (填编号)。
A.氢键 B.离子键 C.共价键
D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可与H2发生加
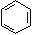 成反应。如①CH2=CH2、②HC≡CH、③ ④HCHO等,其中碳原子采取sp2杂化的分
成反应。如①CH2=CH2、②HC≡CH、③ ④HCHO等,其中碳原子采取sp2杂化的分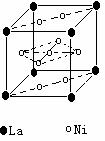 子有 (填物质序号),预测HCHO分子的立体结构为
形。
子有 (填物质序号),预测HCHO分子的立体结构为
形。
(4)氢气是新型清洁能源,镧(La)和镍的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一镍原子,其他镍原子都在晶胞面上。该晶体的化学式是 。
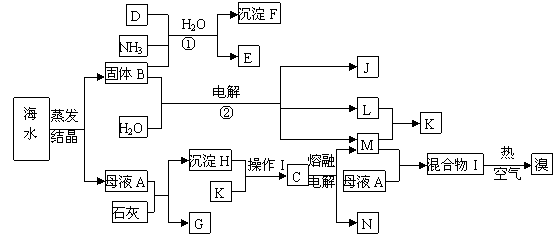
31.[化学--化学与技术]下图是以海水为原料制取金属镁和溴(以NaBr的形式存在)以及其它几种化工产品的综合生产流程图,其中E是一种化肥,N是一种常见的金属单质。

试填写下列空白:
(1)写出反应①②的化学方程式 ,
。
(2)由沉淀H与K反应得到的溶液中如何得到纯净的C固体?
。
(3)在工业上反应②主要采用离子交换膜法,下列关于离子交换膜电解槽的叙述错误的是
(填序号)
A.精制饱和固体B溶液进入阳极室 B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成
(4)工业上制取单质溴,通常是向混合物I中通入热的空气再用SO2吸收,然后经过氯化、蒸馏、分液等操作,简述工业上为什么不用CCl4萃取的方法得到单质溴?
30. (16分)(1) 铜在一定条件下也能被腐蚀。下列图一装置中,铜腐蚀的速度最慢的是(填图一装置序号) ,装置I中观察到的现象是 。
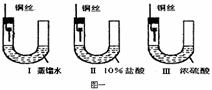
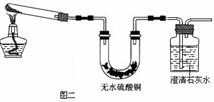
(2)金属铜长期暴露在潮湿空气中,往往被腐蚀成 “铜绿”{碱式碳酸铜:[Cu2(OH)2CO3]},“铜绿”受热易分解。请预测“铜绿”分解的产物 。为验证“铜绿”分解的部分产物,某同学设计了图二装置:
图二装置可初步验证“铜绿”分解的产物,为验证分解的固体产物需要做补充实验,方法是 。
(3)为了从“铜绿”中制得铜,并测定“铜绿”的组成,把“铜绿”放在试管中,与通入的纯净氢气在加热条件下发生反应,实验装置如下图三,请回答下列有关问题:
(i)A处应选用图四装置中的(填写编号) 。
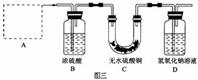
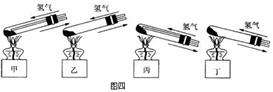
(ii)反应进行时,应先 再 。
(iii)要测定“铜绿”的组成,除需要知道样品质量外还需测定的实验数据是
(iv)上述装置还有不完善之处,请指出改正措施 、
。
29.(14分)磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-和PO43-四种粒子的形式存在,当溶液中的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化。下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH变化曲线:
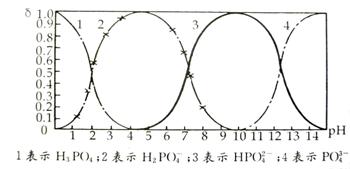
(1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式
(2)向Na3PO4溶液中逐滴滴入稀盐酸,在pH从8降到6的过程中发生的主要反应的
离子方程式为 ,pH=6时,溶液中存在的阴离子有 。
(3)由图可知,Na2HPO4溶液呈碱性,其原因是 。
(4)向Na3PO4稀溶液中加入Na3PO4固体,c(Na+)/c(PO43-)的比值将______(填“增大”、
“减小”或“不变”)。
(5)羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12:在剧烈搅
拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
回答下列问题:
①完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式
A.5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O Ca5(PO4)3OH↓+
+ 。
B.5Ca(OH)2+3H3PO4= 。
②与方法A相比,方法B的优点是 。
③ 牙齿表面的物质主要是Ca5(PO4)3OH,糖黏附在牙齿上在酶的作用下产生酸性物质,易造成龋齿,结合化学平衡移动原理,分析其原因 。
28.(12分)有关元素A、B、C、D的信息如下:
|
元 素 |
有关信息 |
|
A |
最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
|
B |
地壳中含量最高的元素,A与B可形成一种质量比为 7:12的化合物(丙) |
|
C |
单质曾用于焊接钢轨 |
|
D |
单质是生活中常见金属,其制品在自然环境中被腐蚀呈现红棕色 |
请回答下列问题:
(1)用C单质来焊接钢轨的化学方程式是 。
(2)有关C与D元素,下列说法正确的是 (填序号)。
①C或D的高价盐均可用做净水剂
②用C或D单质做成的槽车,都可用来运输甲的稀溶液
③C、D的单质与稀硫酸组成的原电池,C电极发生氧化反应
④C的合金可用来做车船材料和门窗等
(3)B的一种氢化物在碱性溶液中可与丙反应,生成物中A元素只显其最高价态,该反应的离子方程式是 。
(4)现取1 mol·L-1 100 mL的C的氯化物溶液,向其中加入1 mol·L-1氢氧化钠溶液产生了3.9 g的沉淀,则加入的氢氧化钠溶液体积可能是 mL。
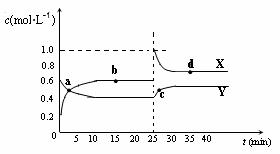 (5)已知:2AB2(g)
(5)已知:2AB2(g) A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如右图所示。
A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如右图所示。
①a、b、c、d四个点中,化学反应处于平衡状态的是 点。
②a、b、c、d四个点中所表示的反应体系中,气体颜色由深到浅的顺序是 (填字母)。
15.下列表格中的各种情况,可以用下面的图像曲线表示的是
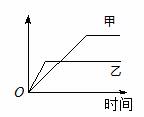
|
|
反应 |
纵坐标 |
甲 |
乙 |
|
A |
相同质量的氨,在同一容器中 2NH3 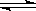 N2
+ 3H2 N2
+ 3H2 |
氨气的转化率 |
500℃ |
400℃ |
|
B |
等质量钾、钠分别与足量水反应 |
H2质量 |
钠 |
钾 |
|
C |
在体积可变的恒压容器中,体积比1:3的N2、H2, N2 + 3H2 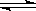 2NH3 2NH3 |
氨气的浓度 |
活性高的 催化剂 |
活性一般的 催化剂 |
|
D |
2 molSO2和1 molO2,在相同温度下2SO2 +
O2 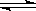 2SO3 2SO3 |
SO3物质的量 |
2个大气压 |
10个大气压 |
14.下列各项中的两个量,其比值一定为2:1的是
A.液面在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛溶液的体积
B.相同温度下,pH = 1和pH = 2的硫酸溶液中的c(H+)
C.在过氧化钠固体中,阳离子和阴离子的个数
D.加热条件下,浓硫酸与碳反应中,参加反应的硫酸与被还原的硫酸的个数
13.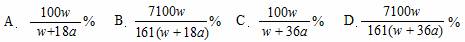 在25 ℃时,将两个铂电极插入一定量饱和Na2SO4溶液中进行电解,通电一段时间后,在阳极上放出a mol气体,同时有w g Na2SO4·10H2O晶体析出。若温度不变,此时剩余溶液中溶质的质量分数为
在25 ℃时,将两个铂电极插入一定量饱和Na2SO4溶液中进行电解,通电一段时间后,在阳极上放出a mol气体,同时有w g Na2SO4·10H2O晶体析出。若温度不变,此时剩余溶液中溶质的质量分数为
12.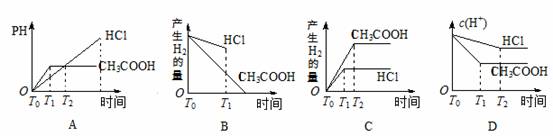 在体积都为1L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则图示比较符合客观事实的是
在体积都为1L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则图示比较符合客观事实的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com