
题目列表(包括答案和解析)
1.下列物质中不属于糖的是( )
A.蔗糖 B.淀粉 C.纤维素 D.糖精
36.化学-选修有机化学基础
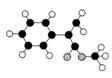
A是生产某新型工程塑料的基础原料之一,分子结构模型如右图所示
(图中球与球之间连线表示单键或双键)。
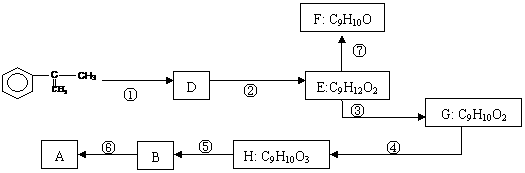 A在酸性条件下水解生成有机物B和甲醇。E的结构简式为
A在酸性条件下水解生成有机物B和甲醇。E的结构简式为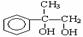 拟从
拟从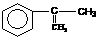 出发合成A。
出发合成A。
(1)写出反应的条件② ________ ③ ⑤
(2)写出结构简式B __________ D ___________ G
(3)已知烯醇式不稳定,会转化为醛:R-CH=CH-OH → R-CH2-CHO。反应⑦生成的有机物F有两种可能F1 、F2,它们的结构简式分别为F1 、F2 ,要把它们区别开来,可使用的试剂是
(4)请模仿:由乙醇合成聚乙烯的反应流程图由F1 合成B。标明每一步的反应物及反应条件。(有机物写结构简式,其它原料自选)
|
 流程图:CH2=CHCH2OH CH3CHBrCH2OH 注:
流程图:CH2=CHCH2OH CH3CHBrCH2OH 注: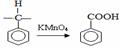
__________________________________________________________________________
35.(15分) 化学-选修物质结构与性质
I、元素的电负性和原子半径一样,也是元素的一种基本性质。
|
元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
O |
S |
|
电负性 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
3.5 |
2.5 |
试结合元素周期律知识判断:某化合物分子中含有S-N键,你认为该共用电子对偏向于________原子(填元素符号)。(3分)
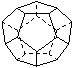 II、德国和美国科学家首先制出由20个碳原子组成的
II、德国和美国科学家首先制出由20个碳原子组成的
空心笼状分子C20,该笼状结构是由许多正五边形构成如右图。
请回答: C20分子共有_______个正五边形,共有_______条棱边,(3分)
III、Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z。
 Q分别与Y、Z形成的共价化合物的化学式是____ ____,其杂化轨道类型分别是________和_______;Q与Y形成的分子属于_______分子(填“极性”或“非极性”)。
Q分别与Y、Z形成的共价化合物的化学式是____ ____,其杂化轨道类型分别是________和_______;Q与Y形成的分子属于_______分子(填“极性”或“非极性”)。
34. (15分)化学-选修化学技术
粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。在实验室条件下以硫酸铜溶液为电解液,用电解的方法对粗铜提纯,并对阳极泥和电解液中金属进行回收和含量测定。
回答以下问题:
步骤一:电解精制:电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)。
步骤二:电解完成后,对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
|
序号 |
反应 |
平衡常数 |
|
1 |
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
|
2 |
Au3+ + 4Cl- = AuCl4- |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因: 。
(2)滤液含量的测定: 以下是该小组探究滤液的一个实验流程:
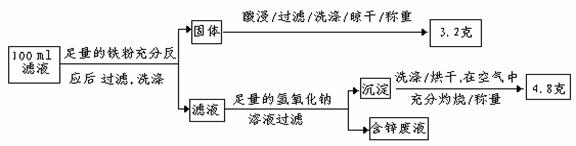
则100mL滤液中Cu2+ 的浓度为 mol·L-1 ,Fe2+的浓度为 mol·L-1
27.(13分) Y是短周期元素组成的单质,为淡黄色固体。Z是一种化合物,焰色反应呈黄色,0.1mol·L-1 Z的水溶液pH=13;C、Y、D都含同一种元素,且此元素化合价依次升高。C、D的水溶液均显碱性。
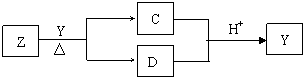
I、写出Y与Z反应的离子方程式:
II、某同学在精确测试D溶液的pH操作时,遇到了困惑。
[实验操作]①准确称取纯净的Na2SO3·7H2O晶体25.20g,配成1L水溶液,测得其pH=7.8。
②再次准确称取25.20g上述晶体,继而隔绝空气600℃以上高温下强热至恒重。
③将②所得12.60g固体进行分析,组成与D无异。将其溶于水测得pH=10.3。
[查阅资料]①H2S的电离常数(25℃) K1=1.3×10-7 K2=7.1×10-15
②H2SO3的电离常数(25℃) K1=1.3×10-2 K2=6.2×10-8
[分析猜想]D·7H2O在强热下失去结晶水,进而发生了分解反应(自身氧化还原反应)
[交流讨论]
(1)判断实验操作②中隔绝空气强热至“恒重”的依据 。
(2) 猜想D在高温强热下发生分解反应的化学方程式是 。
(3)实验操作①和③中,两次测得的溶液pH相差明显,其合理的解释是
。
(4) 请你设计简单的实验方案,验证猜想的正确性。简单叙述实验步骤、现象和结论。
26.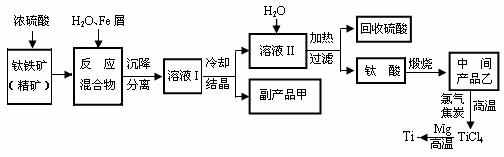 (14分)金属钛(Ti)被誉为“未来金属”。常温时耐酸碱腐蚀而被广泛应用。以含有杂质Fe2O3的钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼钛同时获得副产品甲的生产流程如下:
(14分)金属钛(Ti)被誉为“未来金属”。常温时耐酸碱腐蚀而被广泛应用。以含有杂质Fe2O3的钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼钛同时获得副产品甲的生产流程如下:
回答下列问题:
⑴ 钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲是 。写出该物质的一种用途:
⑵用TiCl4制备乙:TiCl4+(x+2) H2O 乙·x H2O↓+4HCl, 制备时为了促进水解趋于完全,采取的措施:
乙·x H2O↓+4HCl, 制备时为了促进水解趋于完全,采取的措施:
⑶用钛铁矿与氢气反应也可生产乙和水,写出该反应的化学方程式: ;
该反应的还原产物是:
⑷已知:①C(s)+O2(g)=CO2(g);DH=-393.5 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g);DH=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);DH=+141 kJ·mol-1
则TiO2(S)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g) DH=
(5)此工艺需要大量浓硫酸,工业上用:2SO2+O2 2SO3生产硫酸。一定温度下密闭容器中,C(SO2)始=0.4mol/L
C(O2)始=1 mol/L,经测定反应在该温度下的平衡常数K≈19,试判断:当SO2转化率为50%时,反应 (填:是、否)达到平衡状态;若未达到,向
2SO3生产硫酸。一定温度下密闭容器中,C(SO2)始=0.4mol/L
C(O2)始=1 mol/L,经测定反应在该温度下的平衡常数K≈19,试判断:当SO2转化率为50%时,反应 (填:是、否)达到平衡状态;若未达到,向
(填:正、逆)方向进行
25.(必修)(16分)
欲测定 (NH4)2Fe(SO4)2.xH2O中x值,经讨论有多种实验方案。可供选用的试剂如下:
①1.0mol/LBaCl2 ②0.50mol/L NaOH③0.26mol/LH2SO4④ amol/L酸性KMnO4
实验步骤:
第一步:称取(NH4)2Fe(SO4)2.xH2O样品mg,放入250ml锥形瓶中,加适量水溶解 ;
第二步:…
请回答下列问题:
(1)据提供的试剂,设计实验方案完成方案2、3的第二步操作,填写下表:
|
|
加入药品: |
操作方法 |
数据处理 |
|
方案1 |
加过量NaOH溶液 |
加热、干燥NH3,用H2SO4溶液吸收NH3 |
求算NH3质量 |
|
方案2 |
|
|
称量 质量 |
|
方案3 |
|
|
测定 体积 |
(2)①配制100mLamol/lKMnO4溶液,若将溶液注入容量瓶时有溶液溅在容量瓶外,处理方法是
②用 (填仪器名称)装入一定体积的amol/L高锰酸钾溶液;滴定时发生反应的离子方程式是:
③滴定终点时若仰视读数,则X的值 (偏高、偏低)
(3)若用50mL的0.50mol/L NaOH稀溶液和50mL 的0.28mol/L稀H2SO4 测定中和热,则每次实验中除了测定NaOH和稀H2SO4的起始平均温度t1外还需要测定 _______ 温度t2。
13.三鹿奶粉受三聚氰胺污染.氰胺(H2N一C≡N)在一定条件下生成三聚氰胺(C3H6N6),其也可以看成是三聚氰酸中的一OH被一NH2取代后的产物。下列推断正确的是
A.三聚氰胺属于不饱和烃 B.氰胺(H2N一C≡N)生成三聚氰胺为加聚反应
C.氰胺合成三聚氰胺的原子利用率为100% D.三聚氰酸与三聚氰胺互为同分异构体
12.一定温度下,难溶强电解质在饱和溶液中各离子浓度幂的乘积是一个常数,该常数Ksp称为难溶强电解质的溶度积。即:AmBn(s) mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp。室温时AgCl、Ag2CrO4饱和溶液的物质的量浓度分别为1.3×10-5 mol/L 、6.5×10-5mol/L
mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp。室温时AgCl、Ag2CrO4饱和溶液的物质的量浓度分别为1.3×10-5 mol/L 、6.5×10-5mol/L
下列叙述正确的是
A.溶度积:Ag2CrO4大于AgCl
B.通过沉淀反应可使Ag+完全沉淀
C.在0.010 mol·L-1 AgNO3溶液中,AgCl的最大浓度为:1.7×10-8 mol/L
D.分别用等体积蒸馏水和0.01 mol/LHCl洗涤AgCl沉淀,用水洗涤造成AgCl损失量小
11. X+、Y+、M2+、N2-均为含有一定数目电子的短周期元素的简单离子,离子半径大小关系是:N2->Y+、Y+>X+、Y+>M2+,下列比较正确的是
A.原子半径:N可能比Y大,也可能比Y小 B.原子序数:N>M>X>Y
C.M2+、N2-核外电子数:可能相等,也可能不等 D.碱性:M(OH)2>YOH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com