
题目列表(包括答案和解析)
2. C60与现代足球
C60与现代足球 有很相似的结构,它与石墨互为( )
有很相似的结构,它与石墨互为( )
A. 同位素 B. 同素异形体 C. 同分异构体 D. 同系物
1. 日常生活中常用下列方法处理相关问题,其中不涉及化学变化的是( )
日常生活中常用下列方法处理相关问题,其中不涉及化学变化的是( )
A. 用明矾净化河水 B. 蜂蚁螫咬处涂抹稀氨水以消除疼痛
C. 用食醋蒸熏对房间消毒杀菌 D. 硫酸钡作X光透视肠胃的药剂
14.答案:
(1)①xCuCO3·yCu(OH)2·zH2O+(x+y)H 2 = (x+y)Cu+ xCO2+(x+2y+z)H2O
②a→k,j→gf(hi)→de(ed)→hi(gf)→bc(cb)→l
③1.8 CuCO3·Cu(OH) 2·H2O
(2)可行 根据反应xCuCO3·yCu(OH) 2·zH2O=(x+y)CuO+ xCO2↑+(y+z)H2O↑,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成。
13.答案:
 (1)
(1)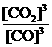
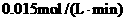
(2)①CO或(CO2)的生成速率与消耗速率相等;②CO(或CO2)的质量不再改变 (合理即给分)
(3) b
(4)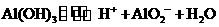 盐酸
(合理即给分)
盐酸
(合理即给分)
12.答案:
(1)Fe + 2Fe3+ = 3Fe2+
(2)加入硫酸,H+浓度增大,使Fe2+
+ 2H2O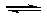 Fe(OH)2 + 2H+的平衡向逆反应方向移动,从而抑制FeSO4的水解
Fe(OH)2 + 2H+的平衡向逆反应方向移动,从而抑制FeSO4的水解
(3)Fe2+ + 2HCO3- = FeCO3↓+ CO2 ↑ + H2O
4FeCO3 + 6H2O + O2 = 4Fe(OH)3 ↓+ 4CO2
(4)取少量洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净
(5)288.0
11.答案:
(1)CO2、CO
(2)焰色反应 透过蓝色钴玻璃,观察到紫色的火焰
 (3)①FeO FeO、Fe
Fe
(3)①FeO FeO、Fe
Fe
|
实验步骤 |
预期现象与结论 |
|
步骤1:取适量固体产物与试管中,加入足量蒸馏水,充分振荡使碳酸钾完全溶解。分离不容固体与溶液,用蒸馏水充分洗涤不溶固体 |
固体产物部分溶解 |
|
步骤2:向试管中加入适量硫酸铜溶液,再加入少量不溶固体,充分振荡 |
(1)
若蓝色溶液颜色及加入的不溶固体无明显变化,则假设2成立。 (2) 若蓝色溶液颜色明显改变,且有暗红色固体生成,则证明有铁单质存在 |
|
步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色。取少量固体与试管中,滴加过量HCl,静置,取上层清液,滴加适量H2O2 ,充分振荡后滴加KSCN |
结合步骤2中的(2): (1) 若溶液基本无色,则假设(1)成立 (2) 若溶液呈血红色,则假设(3)成立 |
③步骤1:将固体产物加入1.0 mol·L-1盐酸中 观察有无气体 若有气泡产生、说明固体产物中含有单质铁,反之,则不含单质铁
步骤2:将固体产物加入足量的0.1 mol·L-1CuSO4中充分反应后过滤、洗涤后,将沉淀物溶于1.0 mol·L-1盐酸,再加入20% KSCN,最后加入3% H2O2,若最终溶液显红色,说明固体产物中含有FeO,若不出现红色、说明不含有FeO
1. B 2.A 3. D 4.B 5C 6.B 7.A 8.A 9 C 10C
14.(09宁夏卷26)碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。
(1)现采用氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ;
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
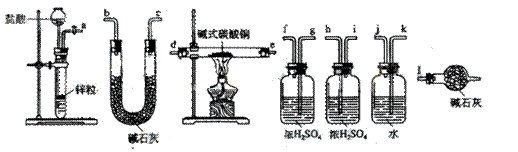
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。
 答案:
答案:
13.(09上海卷25) 铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:

①该反应的平衡常数表达式为:K=
 ②该温度下,在2L盛有
②该温度下,在2L盛有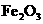 粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
 ①
②
①
②
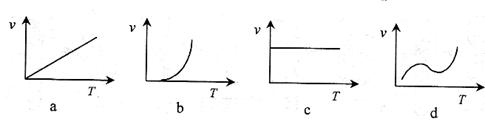
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是 。
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:
欲使上述体系中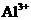 浓度增加,可加入的物质是
。
浓度增加,可加入的物质是
。
12.(09北京卷26)
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
I 从废液中提纯并结晶处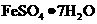 。
。
II将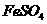 溶液与稍过量的
溶液与稍过量的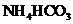 溶液混合,得到含
溶液混合,得到含 的浊液
的浊液
IV 将浊液过滤,用90°C热水洗涤沉淀,干燥后得到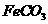 固体
固体
V煅烧 ,得到
,得到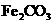 固体
固体
已知: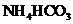 在热水中分解
在热水中分解
(1) I中,加足量的铁屑出去废液中的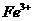 ,该反应的离子方程式是
,该反应的离子方程式是
(2) II中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用
(3) III中,生成 的离子方程式是
。若
的离子方程式是
。若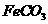 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是
。
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是
。
(4) IV中,通过检验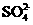 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验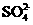 操作是是
。
操作是是
。
(5) 已知煅烧 的化学方程式是
的化学方程式是 ,现煅烧464.0kg的
,现煅烧464.0kg的 ,得到316.8kg产品,若产品中杂质只有
,得到316.8kg产品,若产品中杂质只有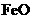 ,则该产品中
,则该产品中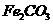 的质量是
kg(摩尔质量/g·
的质量是
kg(摩尔质量/g·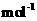 ;
; )
)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com