
题目列表(包括答案和解析)
21、(1)
(2)①不变
②0.00296 mol·L-1·g-1
③“<”或“小于”
(3)阴极. N2O4+2HNO2-2e-=2N2O5+2H+
21、N2O2-是一种新型硝化剂,其性质和制备受到人们的关注.
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是
2N2O5(g)→4NO2(g)+O2(g);ΔH>0
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将 .(填“增大”、“减小”、“不变”)
②下表为反应在T1温度下的部分实验数据:
|
t/s |
0 |
500 |
1000 |
|
e(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500 s内N2O5的分解速率为 .

③在T3温度下,反应1 000 s时测得NO2的浓度为4.98 mol·L-1,则T2 T1.
(3)题26图所示装置可用于制备N2O5,则N2O5在电解池的 区生成,其电极反应式为 .
20.下列离子方程式书写正确的是 ( C )
A.过量的CO2通入NaOH溶液中:CO2+2OH- = CO32 -+H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++ Fe = 3Fe2+
C.足量硫酸铝与碳酸氢钠反应:Al3++3HCO3- = Al(OH)3↓+3CO2↑
D.NaHCO3溶液中加入过量的Ca(OH)2溶液:2HCO3- +Ca2++2OH- = CaCO3↓+2H2O+CO32 -
19、一定能在下列溶液中大量共存的离子组是D
A.pH=0的溶液:Fe2+、Mg2+、NO3-、SO42-
B.由水电离出的c(H+)=1×10-13mol / L的溶液:HCO3-、K+、SO42-、Cl-
C.含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl-
D.pH=14的溶液:Na+、K+、AlO2-、CO32
18.X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生
如下反应:X+2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于:D
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于:D
A、33% B、40% C、50% D、65%
17.碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g) WI2ΔH<0(温度T1<T2)。下列说法正确的是AD
WI2ΔH<0(温度T1<T2)。下列说法正确的是AD
A.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W1W重新沉积到灯丝上
B.灯丝附近温度越高,WI2(g)的转化率越低
C.该反应的平衡常数表达式是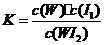
D.利用该反应原理可以提纯钨
16.将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)  2HBr(g)
2HBr(g) g平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是A
g平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是A
A.a>b B.a=b C.a<b D.无法确定
15、工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)=Si(s)+4HCl(g);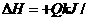 mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是D
mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是D
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C. 反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03
mol/(L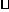 min)
min)
D. 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
14、 已知Ag2SO4的KW 为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是B
已知Ag2SO4的KW 为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是B

13、某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是C

A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的KaP大于c点对应的KaP
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com