
题目列表(包括答案和解析)
0.5mol·L-1,下列判断正确的是 ( )
A.x=1 B.B的转化率为20% C.平衡时A的浓度为1.50mol·L-1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
6、在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:
 3A(g)+B(g) 2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为
3A(g)+B(g) 2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为
5、恒温恒压下,在容积可变的器皿中,反应2NO2(g) N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数(
)
N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数(
)
A. 不变 B. 增大 C. 减少 D. 无法判断
4、可以充分说明反应P(g)+Q(g)
 R(g)+S(g)在恒温下已达到平衡的是( )
R(g)+S(g)在恒温下已达到平衡的是( )
A.反应容器内的压强不随时间改变 B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等 D.反应容器内的气体总物质的量不随时间变化
3、CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如下图所示.下列结论不正确的是 ( )
A.反应开始2分钟内平均反应速率最大
B.反应从第2min到第4min间生成的CO2平均反应速率最大
C.反应开始4分钟内温度对反应速率的影响比浓度大
D.反应4分钟后平均反应速率最小
2、下列有关叙述中正确的是:( )
A 难溶于水的电解质一定是弱电解质
B 强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强
C 易溶于水的电解质一定是强电解质
 D 强电解质在水溶液中的电离过程是不可逆的
D 强电解质在水溶液中的电离过程是不可逆的
1、下列物质中,导电性能最差的是:( )
A 熔融氢氧化物 B 石墨棒 C 盐酸溶液 D 固态氯化钾
28.(共9分,每空1分)
(1)Fe -2e = Fe2+
(2)2H+ + 2e- = H2↑
2Cl- + 2H2O 电解 2OH- + H2↑ + Cl2↑ ②
(3)① 4OH- - 4e- = 2H2O + O2↑ , <
② D
③ H+放电,促进水的电离,OH-浓度增大
④ O2 + 2H2O + 4e- = 4OH-

28.(共9分)某课外活动小组同学用右图装置进行实验,试回答下列问题。
(1)若开始时开关K与a连接,则B极的电极反应式为 。
(2)若开始时开关K与b连接,则B极的电极反应式为
, 总反应的离子方程式为

有关上述实验,下列说法正确的是(填序号)

①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
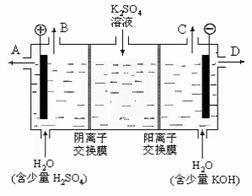 (3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图9装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图9装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾

图8 图9
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填“大于”或“小于”或“等于”)一通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”) 导出
③通电开始后,阴极附近溶液pH会增大,请简述原因 。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为

27、(1)
|
排除的离子 |
排除的依据 |
|
NH4+ Ag+、Mg2+ |
由于溶液呈碱性,且未嗅到刺激性气味 碱性溶液中无沉淀生成 |
(2)
|
肯定存在的离子 |
判断依据 |
|
AlO2- CO32- |
加酸有沉淀,继续加酸沉淀溶解 加酸后有无色无味气体逸出 |
|
排除的离子 |
排除的依据 |
|
Ba2+ SO32- |
有CO32-
存在时原溶液无沉淀 酸化后逸出的气体没有刺激性气味 |
(3)
|
尚待检验的离子 |
检验方法 |
|
K+、 Na+ SO42- |
焰色反应 酸账溶液中滴加BaCl2溶液,是否有白色沉淀生成 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com