
题目列表(包括答案和解析)
2.(2010年全国2)三位科学家因在烯烃复分解反应研究中的杰出贡献而荣获2005年度诺贝尔化学奖,烯烃复分解反应可示意如下:

 w_w w. k#s5_
w_w w. k#s5_

下列化合物中,经过烯烃复分解反应可以生成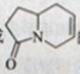 的是
的是

解析:依据烯烃复分解反应原理可知只有选项A正确。
答案:A
1.(2010年全国新课标)下列各组中的反应,属于同一反应类型的是
A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C.由氯代环己烷消去制环己烯;由丙烯加溴制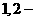 二溴丙烷
二溴丙烷
D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
解析:A中反应类型分别为取代反应和加成反应;B中反应类型分别为取代反应和氧化成反应;C中反应类型分别为消去代反应和加成反应;D中反应类型分别为取代反应和取代反应。所以选项D正确。
答案:D
10.(2010年江苏高考)设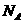 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是

 w_w w. k#s5_
w_w w. k#s5_
A.常温下,1L0.1mol/L的 溶液中氮原子数为0.2
溶液中氮原子数为0.2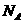
B.1mol羟基中电子数为10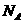
C.在反应KI+6HI=KI+3I2+3H2O中,每生成3mol 转移的电子数为6
转移的电子数为6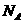
D.常温常压下W W W K S 5 U . C O M
,22.4L乙烯中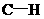 键数为4
键数为4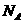
解析:本题主要是以阿伏伽德罗常数为载体考查如下知识点①考查22.4L/mol的正确使用;②考查在氧化还原反应中得失电子数的计算等内容。无论NH4+水解与否,根据元素守恒,A正确; 1mol羟基中有9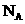 个电子,因此选项B 错误;在该反应中,6mol HI参与反应被氧化的是5ml,因此每生成3mol
个电子,因此选项B 错误;在该反应中,6mol HI参与反应被氧化的是5ml,因此每生成3mol ,转移5
,转移5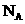 个电子,所以选项C错误;D项,常温常压下,气体摩尔体积
个电子,所以选项C错误;D项,常温常压下,气体摩尔体积 不是22.4L/mol。综上分析得知,本题选A项。
不是22.4L/mol。综上分析得知,本题选A项。
答案:A


 w_w w. k#s5_
w_w w. k#s5_
9.(2010年上海)将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是

 w_w w. k#s5_
w_w w. k#s5_

解析:本题主要考查了元素化合物、图像数据的处理知识。向NaOH和Na2CO3混合溶液中滴加盐酸时,盐酸首先和NaOH反应生成水和氯化钠,由已知数据可知当滴入0.1L时,两者恰好反应完全;继续滴加时,盐酸和Na2CO3开始反应,首先发生反应:HCl+ Na2CO3= NaHCO3+NaCl,不放出气体,当再加入0.1L时,此步反应进行完全;继续滴加时发生反应:NaHCO3+HCl =NaCl+H2O+CO2↑,此时开始放出气体。由以上分析可知选C。
答案:C
8.(2010年上海)NA表示阿伏加德罗常数,下列叙述正确的是

 w_w w. k#s5_
w_w w. k#s5_
A.等物质的量的N2和CO所含分子数均为NA
B.1.7g H2O2中含有的电子数为0.9 NA
C.1mol Na2O2 固体中含离子总数为4 NA
D.标准状况下,2.24L戊烷所含分子数为0.1 NA
解析:本题主要考查了阿伏伽德罗常数的有关知识。阿伏伽德罗常数是指1mol任何微粒中含有的微粒数,等物质的量不一定是1mol,A错;H2O2的相对分子质量为34,故其1.7g的物质的量为0.05mol,因1个分子中含有的电子数为18个,则其1.7g中含有的电子的物质的量为0.05mol ×18=0.9mol,数目为0.9NA,B正确;Na2O2是由Na+和O22-两种离子组成,两种微粒的个数比是2:1,因此1mol Na2O2固体中含有3mol离子,故C错;戊烷在标准状况下为液态,因此2.24L不是0.1mol,D错。
答案:B
7.(2010年上海)由5mol Fe2O3、4mol Fe3O4和3mol FeO组成的混合物,加入纯铁1mol并在高温下和Fe2O3反应。若纯铁完全反应,则反应后混合物中FeO与Fe2O3的物质的量之比可能是
A.4:3 B.3:2 C.3:1 D.2:l
解析:本题主要考查了化学计算知识。本题可以采用极端假设法进行讨论。分析题给混合物和高温下发生的反应,可知当Fe2O3+Fe=3FeO时,反应后混合物中含有6molFeO、4molFe2O3,则FeO与Fe2O3的物质的量之比为:3:2;当发生反应:Fe2O3+Fe+FeO=Fe3O4时,反应后混合物中含有2molFeO、4molFe2O3,则FeO与Fe2O3的物质的量之比为:1:2;当两反应均存在时,FeO与Fe2O3的物质的量之比处于两着之间,故BC可能。
答案:BC
6.(2010年全国1)一定条件下磷与干燥氯气反应,若0.25g磷消耗掉314mL氯气(标准状况),则产物中PCl3与PCl5的物质的量之比接近于

 w_w w. k#s5_
w_w w. k#s5_
A.1:2 B.2:3 C.3:1 D.5:3
解析:设n(PCl3)=X mol, n(PCl5)=Y mol,由P元素守恒知:X+Y=0.25/31≈0.008…①;
由Cl元素守恒知:3X+5Y=(0.314×2)/22.4≈0.028……②,联立之可解得:X=0.006,
Y=0.002,故选C
答案:C
5.(2010年四川)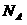 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是

 w_w w. k#s5_
w_w w. k#s5_
A. 标准状况下,22.4L二氯甲烷的分子数约为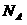 个
个
B. 盛有 的密闭容器中含有
的密闭容器中含有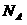 个氧原子,则
个氧原子,则 的物质的量为0.5mol
的物质的量为0.5mol
C. 17.6g丙烷中所含的极性共价键为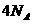 个
个
D. 电解精炼铜时,若阴极得到电子数为 个,则阳极质量减少64g
个,则阳极质量减少64g
解析:本题考查微粒数与物质的量、物质的质量等之间的关系;二氯甲烷在标况下为液态,22.4L不一定为1mol,A项错误;1molSO2中含有氧原子2mol,故含有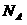 个氧原子的
个氧原子的 的物质的量为0.5mol,B项正确;17.6g丙烷的物质的量为0.4mol,1mol丙烷中含有极性键8mol,故0.4mol中含有极性键3.2mol,为3.2NA个,C项错误;精炼铜时,阳极为粗铜,当转移2mol电子时,阳极消耗的质量不一定为64g,D项错误。
的物质的量为0.5mol,B项正确;17.6g丙烷的物质的量为0.4mol,1mol丙烷中含有极性键8mol,故0.4mol中含有极性键3.2mol,为3.2NA个,C项错误;精炼铜时,阳极为粗铜,当转移2mol电子时,阳极消耗的质量不一定为64g,D项错误。
答案:B
4.(2010年四川)标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为p g/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是

 w_w w. k#s5_
w_w w. k#s5_
A. B.
B. 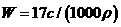
C. 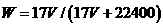 D. C=1000Vρ/(17V+22400)
D. C=1000Vρ/(17V+22400)
解析:本题考查基本概念。考生只要对基本概念熟悉,严格按照基本概念来做,弄清质量分数与物质的量浓度及密度等之间的转化关系即可。在该溶液中溶质的物质的量为: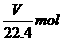 ,其质量为:
,其质量为: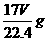 ;溶剂的质量为:1000g;故溶液的总质量为:
;溶剂的质量为:1000g;故溶液的总质量为:
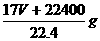 ,因此溶液体积为:
,因此溶液体积为: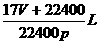 。所以溶液的物质的量浓度为:
。所以溶液的物质的量浓度为:
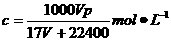 ,质量分数为:
,质量分数为: 。又因为
。又因为 ,整理后
,整理后 ,所以A正确。
,所以A正确。
答案:A
3.(2010年全国新课标)把500 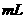 有BaCl2和KCl的混合溶液分成5等份,取一份加入含
有BaCl2和KCl的混合溶液分成5等份,取一份加入含
 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为

 w_w w. k#s5_
w_w w. k#s5_
A.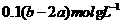 B.
B.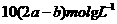
C.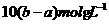 D.
D.
解析:根据反应方程式Ba2++SO42-=BaSO4↓和Ag++Cl-=AgCl↓可知,在每100ml
混合溶液中含有Ba2+是 mol,Cl-是
mol,Cl-是 mol。由电荷守恒知钾离子得物质的量为:
mol。由电荷守恒知钾离子得物质的量为:
 mol-2
mol-2 mol,所以其物质的量浓度为:
mol,所以其物质的量浓度为: ,即选项D正确。
,即选项D正确。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com