
题目列表(包括答案和解析)
8.(15分)
(1)蒸馏法(1分)、离子交换法(其它答案合理给分)(1分)
(2)Cl2(1分)、NaOH(1分)、NaClO(1分)
(3)富集溴元素(1分)
(4)Br2+SO2+2H2O=4H++SO42-+2Br-(2分),强酸对设备的严重腐蚀(1分)
(5)①冷凝管(1分) ②Br2腐蚀橡胶(1分)
③控制温度计b的温度,并收集59℃是的馏分(2分)
④深红棕色(1分),分液(或蒸馏)(1分)
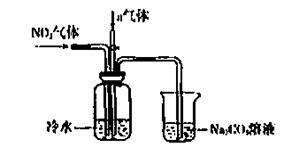 9/某课外小组模拟上述部分过程设计了如下实验装置制备硝酸(所有橡胶制品均已被保护)
9/某课外小组模拟上述部分过程设计了如下实验装置制备硝酸(所有橡胶制品均已被保护)
(1)工业上用氨气制取NO的化学方程式是 。
(2)连接好装置后,首先进行的操作是 。
(3)通入a气体的目的是 .
(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生反应的化学方程式是
2NO2+Na2CO3=====NaNO2+ +
(5)已知:温度低于21.15°C时,NO2几乎全部转变为N2O2。工业上可用N2O4与水反应来提高硝酸产率。N2O4与a气体在冷水中生成硝酸的化学方程式是 。
 (6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L。则2NO2(g) N2O4(g)的平衡常数K=
。若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为
。
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L。则2NO2(g) N2O4(g)的平衡常数K=
。若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为
。
|
|
 =====4NO+6H2O
=====4NO+6H2O
(2)检验装置的气密性
(3)提高NO2的转化率(或2NO+O2=2NO2)(合理均给分)
(4)NaNO3 CO2
(5)2N2O4+O2+2H2O=4HNO3[来源:高&考%资(源#网]
(6)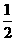 50%
50%
8.(15分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
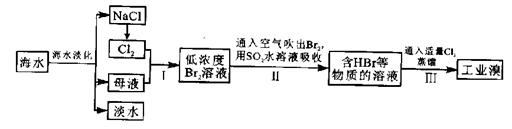
(1)请列举海水淡化的两种方法:____________、____________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、______或H2、_________。
(3)步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为__________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_________________________,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是____________________。

 (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称:___________________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为________________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:________。
④C中液体产物颜色为___________________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________________________。
7.(15分) (1)BaCl2或Ba(OH)2, HCl(2)过滤 CaCO3、BaCO3 和BaSO4
(3)除去过量的Na2CO3,提纯NaCl (4)蒸发皿
(5)G、F、I D、E、C
(6)负极 2Cl--2e →Cl2↑
(7)KI淀粉溶液变蓝
(8)12
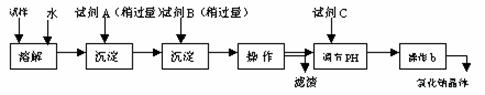
7.(15分) 某同学设计了以下操作流程来除去混在氯化钠固体中的少量硫酸钠和氯化钙。
 [来源:
[来源:
(1)试剂A是 ,试剂C是 。
(2)操作a的名称是 ,操作a得到的滤渣的成分是 。
(3)加入试剂C调节滤液PH的目的是 。
(4)操作b中用到的主要仪器为酒精灯、 、三脚架和玻璃棒。
该同学想利用上述得到的氯化钠设计一套实验装置来电解饱和食盐水,并检验氯气的氧化性和测定所产生的氢气的体积(约8mL)。
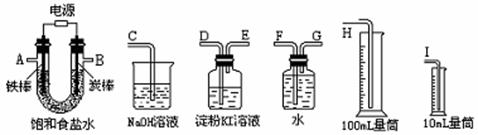
(5)试从上图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:A接__ _ , 接___ ;B接___ , 接__ _ ;
(6)铁棒接直流电源的________极;炭棒上发生的电极反应为 ;
(7)能说明氯气具有氧化性的实验现象是_________________________ ________ ;
(8)若装入的饱和食盐水为75mL(电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为8.4mL(标准状况)时停止通电。将U形管内的溶液倒入烧杯,其pH约为___。
6.(共12分)(1)ClO-+H2O HClO+OH-
HClO+OH-
(2)漂白纸浆
(3)c(SO)>c(K+)>c(Al3+)>c(H+)>c(OH-)
(4)①Al3++3ClO-+3H2O===3HClO+Al(OH)3↓
②4HClO2Cl2↑+O2↑+2H2O
(5) 2∶3
[解析]本题是结合NaClO和KAl(SO4)2的性质试题,涉及盐类水解、离子浓度大小的比较和化学计算等内容。NaClO是强碱弱酸盐,水解而显碱性;NaClO中氯为+1价,故NaClO具有强氧化性,可以用于漂白纸浆;KAl(SO4)2中Al3+要水解显酸性,故c(SO)>c(K+)>
c(Al3+)>c(H+)>c(OH-);将NaClO和KAl(SO4)2溶液混合后,ClO-和Al3+要发生双水解生成Al(OH)3和HClO;在阳光照射下HClO会发生分解生成Cl2和O2,根据得失电子守恒可以写出该反应的化学方程式;KAl(SO4)2和Ba(OH)2反应生成BaSO4和Al(OH)3的混合物,即OH-完全反应时沉淀达到最大量,此时两溶液的体积比为2∶3。
6.(12分)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液呈溶液pH>7,原因是(用离子反应方程式表示) 。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是 。
(3)在1 mol/L的KAl(SO4)2溶液中离子浓度由大到小的顺序是 。
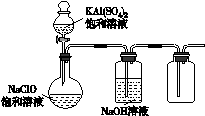 (4)某小组同学用右图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。
(4)某小组同学用右图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。
①打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。反应的离子方程式是 。
②将烧瓶中的混合液在阳光照射下,不久有黄绿色气体产生。充分反应后集气瓶中收集到能使带余烬木条复燃的无色气体。写出在光照下混合液中反应的化学方程式
。
(5)若将V1 mL 0.1 mol/L的KAl(SO4)2溶液和V2 mL 0.1 mol/L的Ba(OH)2溶液混合,当产生沉淀的物质的量最多时,V1∶V2= 。
5.(10分)
 (1)(2分)Al3++3NH3·H2O=Al(OH)3 ↓+3NH4+
(1)(2分)Al3++3NH3·H2O=Al(OH)3 ↓+3NH4+
(2)(2分)Ca(OH)2(s) Ca2++2OH-
+
 Mg2+
Mg2+
Mg(OH)2(s)
(3)(2分)Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失
(4)①(2分)2C1--2e-=Cl2↑
②(2分)2Li2OH+NH4HCO3=Li2CO3+NH3+2H2O
5.(10分)工业上以锂辉石(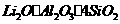 ,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
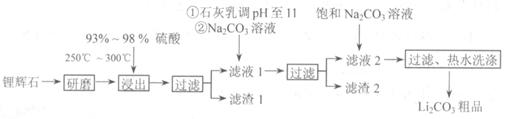
已知:①
②某些物质的溶解度(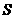 )如下表所示。
)如下表所示。
|
T/℃ |
20 |
40 |
60 |
80 |
|
S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
|
S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出A12O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤II中反应的离子方程式是 。
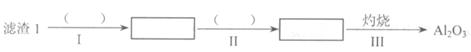
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。
向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是 。
②b中,生成Li2CO3反应的化学方程式是 。
4.(12分)某化学兴趣小组以碳和浓硝酸为起始原料,想利用一氯化氮与过氧化钠反应制备亚硝酸钠。设计装置如下:(忽略装置中空气的影响)
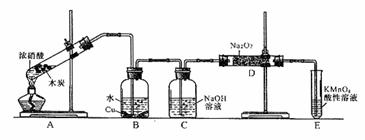
请回答下列问题:
(1)装置A的试管中发生反应的化学方程式是 。
(2)猜测B中可以观察的主要现象是
。C瓶出来的气体是 。
(3)已知:①室温下存在反应3HNO2=HNO3+2NO↑+H2;②在酸性溶液中,NO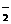 可将MnO
可将MnO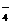 还原为Mn2+且无气体生成。写出检验D中产物是亚硝酸钠的方法:
还原为Mn2+且无气体生成。写出检验D中产物是亚硝酸钠的方法:
。
(4)E装置的作用是 。
(5)同学们经过讨论认为上述装置仍有缺陷,为避免D管中生成NaOH,你认为应该进行的改进是 。
|
(1)C+4HNO3(浓) CO2↑+4NO2↑+2H2O
(2)溶液逐渐变蓝;NO(或一氧化氮);
(3)方法I:将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠。反应的离子方程式是3NO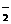 +2H+=NO
+2H+=NO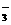 +2NO↑+H2O
+2NO↑+H2O
方法II:将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠,反应的离方程式是5 NO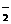 +2MnO
+2MnO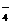 +6H+=5
NO
+6H+=5
NO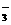 +2Mn2++3H2o
+2Mn2++3H2o
(其它合理答案均得分)
(4)吸收D中未反应完的NO,以免污染空气(其它合理答案均得分)
(5)在C、D之间增加一个盛浓硫酸的洗气瓶(或装无水CaCl2的干燥管)
(其它合理答案均得分)
3.(每空2分,共14分)
(1) CO2 NH4F
 (2)NH
(2)NH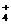 +H2O NH3·H2KO+H+
+H2O NH3·H2KO+H+
 HCO
HCO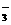 +H2O H2CO3+OH
+H2O H2CO3+OH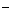
NH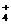 和HCO
和HCO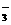 的水解程度基本相同
的水解程度基本相同
(3)取洗涤后的溶液,向其中滴加BaCl2溶液,无现象,说明已经洗涤干净;若有白色沉淀生成,说明没有洗涤干净。(其他方法合理给分)
(4)60℃ c1
(5)温度升高NH4F会分解(或答出NH4HCO3会分解也给分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com