
题目列表(包括答案和解析)
10.科学家合成了元素周期表上的第113号和第115号元素,第115号元素的 X原子在生成数微秒后会衰变成
X原子在生成数微秒后会衰变成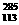 X。下列有关叙述中,正确的是 ( )
X。下列有关叙述中,正确的是 ( )
A.115号元素衰变成113号元素是化学变化
B.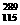 X和
X和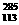 X是两种核素
X是两种核素
C.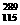 X的中子数与质子数之差为174
X的中子数与质子数之差为174
D.113号元素位于周期表第八周期
9.生活离不开化学,下列有关说法正确的是 ( )
A.乙醇和汽油都是可再生能源,应大力推广使用“乙醇汽油”
B.二氧化硅可用于光导纤维和太阳能电池
C.明矾和漂白粉都可用于自来水的消毒
D.发展“低碳经济”有利于缓解“温室效应”
14.(12分)用NaOH、H2O、大理石和盐酸制取33 g纯NaHCO3,请参照物质的溶解度回答下列问题:
|
25℃ |
溶解度/g |
|
NaOH |
100 |
|
NaHCO3 |
9 |
|
Na2CO3 |
30 |

(1)写出制取过程中反应的化学方程式。
(2)若提供100 g水,则需NaOH的物质的量为多少?
(3)简述实验的操作过程。
(4)在上图反映上述实验过程的图象中,标出A点[即当n(CO2)/n(NaOH)=1/3,且n(CO2)=0.125 mol]的位置,并判断此时所得盐的组成及其物质的量。
13.(12分)由NaOH和NaHCO3组成的固体混合物A mol 置于密闭容器中加热至200℃,充分反应后排出气体,得残余固体y mol。若以x表示原混合物中NaOH的物质的量分数,试回答:

(1)当x=25%时,y的值;
(2)当x=75%时,y的值;
(3)若以x为横坐标,y为纵坐标,在图中画出x、y的关系曲线,并求出y=f(x)的关系式。
12.(8分)已知氧化物有:普通氧化物,如Na2O;过氧化物,如Na2O2;超氧化物,如KO2;臭氧化物,如RbO3。其中后三种均能与水或CO2反应产生O2,试分别写出KO2、RbO3与CO2反应的化学方程式:
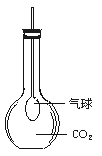
现已用平底烧瓶收集得到CO2,在瓶内有一只紧扎在玻璃管末端的气球,如上图所示。打开塞子迅速往瓶里加入下列物质中的 (填序号),立即塞紧塞子,一段时间后,气球就会自动膨胀起来。
A.Na2O B.Na2O2 C.KO2 D.RbO3
11.(10分)为了制取纯净干燥的气体A,可用下图所示装置,生成A的速度可通过滴入液体B的速度控制。已知A是一种无色、无味、不能使酸碱指示剂变色,也不会在空气中燃烧的气体。
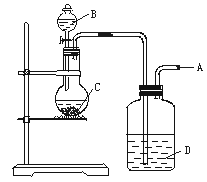
(1)A是 。
(2)若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式为 。
(3)若C是一种黑色粉末,则B物质是 ,C物质的作用是 。
(4)洗气瓶中的试剂是 ,其作用是 。
10.(10分)呼吸面具中Na2O2可吸收CO2放出O2,若用超氧化钾(KO2)代替Na2O2也可起同样的作用。
(1)写出KO2与CO2反应的化学方程式 。化学
(2)1 kg Na2O2和1 kg KO2 分别跟CO2反应,生成的O2的质量比为 。
(3)等质量的CO2分别与足量的Na2O2、KO2反应,生成的O2的质量比为 。
(4)你认为选用 作补氧剂更合适,理由是 。
9.(8分)在三个密闭容器内分别装有:A.Na2O2和NaHCO3,B.Na2O2和NH4HCO3,C.Na2O2和Ca(HCO3)2,其中每种物质均为1 mol。将它们加热至300℃,经充分反应后排出气体,写出各容器内残留的固体物质名称及其物质的量。A ,B ,C ,如分别加入相同浓度的足量稀H2SO4与残留物完全反应,则消耗硫酸的体积从大到小的顺序依次为 。
17.(10分)取两种钠的正盐A和B,溶于1 L 0.2 mol·L-1的盐酸溶液得淡黄色固体C和溶液D(溶液体积仍为1 L,下同)。过滤分离出固体C,经洗涤、干燥后在空气中燃烧,把生成的1/3量的气体E导入溶液D又得固体物C(其质量和前一次得到的相同)和溶液F。F中氢离子浓度为0.01 mol·L-1。向F中加A或B,或导入气体E,均未见有固体物生成。
(1)A、B、C、E各为何物?
(2)溶液D、F中各含哪些物质?它们的物质的量浓度各为多少?
16.某待测溶液(阳离子为Na+)中可能会有SO 、S2-、SO
、S2-、SO 、Cl-、Br-、NO
、Cl-、Br-、NO 、CO
、CO 、HCO
、HCO 中的一种或若干种。进行下列实验(如下图所示)(每次实验所加试剂均过量):
中的一种或若干种。进行下列实验(如下图所示)(每次实验所加试剂均过量):

回答以下问题:
(1)待测液是否含有SO 、SO
、SO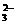 ?答:
化学
?答:
化学
(2)沉淀B的化学式为 。
(3)根据以上实验,待测液中肯定没有的离子是 ,肯定存在的离子是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com