
题目列表(包括答案和解析)
3、药品Wg(W<1)锌片,稀H2SO4无水硫酸铜、氧化铜和水,请从下图中选用适当实验装置,设计一个最简单的实验,粗略测定锌的相对原子质量。(假设环境为标准状况)
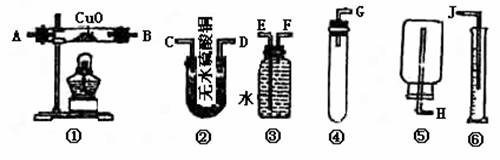
(1)应选用的装置是_________________________________。
(2)所用装置的连接顺序是(填接口字母)____________________________。
(3)操作中,怎样加放试剂以保证不漏出______________________________。
(4)用实验所测的数据,写出计算锌的相对原子质量的数学表达式__________。
2、课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
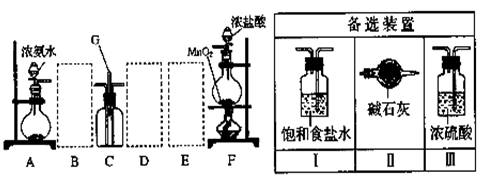
请回答下列问题:
(1)装置F中发生反应的离子方程式是 。
(2)装置A中的烧瓶内固体可选用 (选填以下选项的代号)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从右图的备选装置中选择,并将编号填入下列空格。B 、D 、E 。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为: ;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵: 。
(5)若从装置C和G处逸出的尾气中含有N2和少量C12,应如何处理?
。
1、所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去)。请根据下列要求回答问题。

(1)若烧瓶中盛装锌片,分液漏斗中盛装稀硫酸,则:
① 当仪器连接顺序为A→C→B→B→D时,两次使用B装置,其中所盛的药品依次是CuO、无水CuSO4粉末。此实验的目的是 。D装置的作用是 。
② 为了使B中CuO反应充分,在不改变现有药品的条件下,可采取的方法有(写一种) 。
③ 加热前必须进行的操作是 。
(2)若烧瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞,则:① 烧瓶内产生的气体主要有(写化学式) 。
② 用产生的气体做氨的催化氧化实验,各仪器装置按气流方向从左到右连接顺序是(填字母)( )→( )→( )→( );装置B中可能观察到的现象是 。
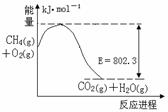
14.英国国家海洋学中心于2009年8月14日发布新闻公报说,中心的研究人员及其同行利用声呐等手段探测到北极海洋中存在大量甲烷气泡,证实了全球变暖会使海底释放大量甲烷的说法。研究人员认为,这些甲烷可能会反过来加剧全球变暖。
(1)下图是1molCH4和O2完全反应生成CO2气体与水蒸气过程中能量变化示意图,又已知 H2O(l)=H2O(g) △H=44.0kJ·mol-1, 请写出1molCH4和O2完全反应生成CO2气体与液态水的热化学方程式 。
(2)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,氢气虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如甲烷(天然气)、汽油等。电池的构造如图所示:两个电极均由多孔碳制成,通入的气体由孔隙中流出,并从电极表面放出。
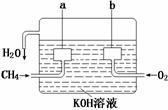
①请写出甲烷燃料电池中a极的电极反应式为 。
②此时电池内的总反应方程式为 。
(3)某课外活动小组利用如图所示装置探究甲烷于氯气的反应。根据题意,回答下列问题:
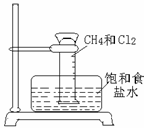
①CH4与Cl2发生反应的条件是
;若用日光直射,可能会引起

 。
。
②实验中可观察的实验现象有:量筒内壁出现油状液滴,饱和食盐水中有少量固体析出, , 等。
③用饱和食盐水而不用水的原因是 。[
④实验中生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体--光气,反应化学方程式为2CHCl3+O2 → 2COCl2+2HCl,上述反应  (填选项符号,下同)
(填选项符号,下同)
A.属于取代反应 B.不属于取代反应
为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是
A.氢氧化钠溶液 B.硝酸银溶液 C.稀盐酸
D.水 E.湿润的蓝色石蕊试纸 F.湿润的无色酚酞试纸

13.2009年10月1日,我国成功举办国庆六十年阅兵活动。其中阅兵仪式上9辆电 动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合 成甲醇:
成甲醇:
反应Ⅰ: CO(g) + 2H2(g)  CH3OH(g)
ΔH1
CH3OH(g)
ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) +
H2O(g)
CH3OH(g) +
H2O(g)  ΔH2
ΔH2
① 上述反应符合“原子经济”原则的是 _____(填“Ⅰ”或“Ⅱ”)。
② 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
|
温度[ |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 = -566.0 kJ/mol
③  H2O(g) = H2O(l) ΔH3 = -44.0 kJ/mol
H2O(g) = H2O(l) ΔH3 = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,
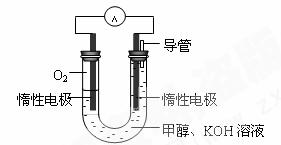
①设计如图所示的电池装置。该电池正极的电极反应为 。
② 工作一段时间后,测得溶液的pH减小,
该电池总反应的化学方程式为 。

12.2009年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是 ( )
( )

A.左边为该电池的正极
B.该电池可在高温环境下使用[]
C.该电池负极反应为:H2-2e-=2H+
D.该电池正极反应为O2+4e-=2O2-
答案:C[]
解析:根据燃料电池的原理,其正极通入空气(或氧气),负极通入H2故A错误,而在高温下氢气与氧气混合会导致爆炸,B错误。
11.《中华人民共和国食品安全法》于2009年6月1日起实施。下列做法不利于食品安全的是:
A.用聚氯乙烯塑料袋包装食品
B.在食用盐中添加适量的碘酸钾
C.在食品加工中科学使用食品添加剂
D.研发高效低毒的农药,降低蔬菜的农药残留量
答案:A
解析:由于聚氯乙烯塑料在一定条件下能产生有 毒物质,所以不可以作包装食品袋。
毒物质,所以不可以作包装食品袋。
10.2009年5月27 日,安徽广德县一名六岁男孩误将“84”消毒液当作饮料喝下一点,引起咽部红肿。市场上销售的“84”消毒液,其商品标识上注明:①本品为无色液体,呈碱性;②使用时应加水稀释;③可对餐具、衣物进行消毒,可漂白浅色衣物。其有效成分是( )[
日,安徽广德县一名六岁男孩误将“84”消毒液当作饮料喝下一点,引起咽部红肿。市场上销售的“84”消毒液,其商品标识上注明:①本品为无色液体,呈碱性;②使用时应加水稀释;③可对餐具、衣物进行消毒,可漂白浅色衣物。其有效成分是( )[
A.NaClO B.NaCl C.KMnO4 D.Cl2
答案:A
解析:B项NaCl呈中性;C项KMnO4溶液显紫色;D项水溶液显酸性;故A项符合题意。
9.2009年3月以来,墨西哥、美国、中国等国家接连发生甲型H1N1流感疫情。目前,达菲是治疗甲型H1N1流感的一种良药。达菲的分子式是C16H31N2PO8,其相对分子质量为410,请回答:
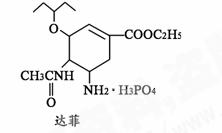
(1)该化合物中碳、氢两种元素的质量比是 。
(2)该化合物中氧元素的质量分数是 。(保留一位小数)
(3)现取820g达菲,含________molO,_______molP。
答案:(1)192∶31;(2)31.2%;(3)16 2。
解析:(3)该化合物的摩尔质量为410 g·mol-1,则其化合物物质的量为n=982g/410 g·mol-1=2mol,故n(O)=16mol,n(P)=2mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com