
题目列表(包括答案和解析)
2、性质强弱规律
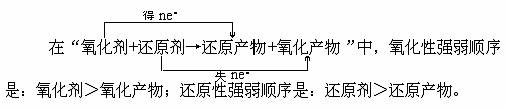
1、表现性质规律
同种元素具有多种价态时,一般处于最高价态时只具有氧化性、处于最低价态时只具有还原性、处于中间可变价时既具有氧化性又具有还原性。
在氧化还原反应中,有五对既相对立又相联系的概念。它们的名称和相互关系是:

12.(15分)(1) FeS(3分)
(2) (3分)
(3分)
(3)分子晶体 (3分)
(4)先加KSCN溶液无现象,再加氯水溶液变血红色(合理答案同样给分)(3分)
(5) 4FeS2(s)+11O2(g) = 2Fe2O3(s)+8SO2(g);ΔH=-3412 kJ·mol-1(3分)
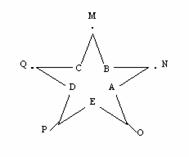
12.(15分)今有A、B、C、D、E五种常见单质,常温下A呈气态,其余为固态,N分子中各原子均满足八电子稳定结构;又知过量B与A作用产生白雾,B与过量A作用产生白烟;E在A中燃烧产生棕色的烟;Q遇水立刻水解产生白色絮状沉淀和气体,该沉淀能溶于氢氧化钠溶液但不溶于氨水;P为黑色固体且能溶于稀盐酸。试回答下列问题:
(1)写出P的化学式
(2)N的电子式:____________ _
(3)B的单质晶体类型:___________
(4)检验 P溶于稀盐酸后溶液中的金属阳离子的方法是_________________________
(5) 已知ED2的燃烧热为853KJ/mol,写出ED2在氧气燃烧的热化学方程式:
____________________________________
11.(14分)化合物A为一种常见金属元素与一种常见非金属元素组成的化合物,阳离子与阴离子的个数比为2:3。K为常见固态非金属单质,J为常见气态单质。其余为化合物,其中I、F在常温下为液态,C、D为刺激性气体,H无色无味气体,B为白色胶状沉淀,L为氯碱工业中的常见产品。F的浓溶液与K加热可生成D和H。(部分生成物未标出)
 (1)写出H的电子式
(1)写出H的电子式
(2)写出下列物质的化学式:
E J
(3)写出下列变化的化学方程式:
A + I → B + C
F的浓溶液与K加热可生成D和H
(4)写出下列变化的离子方程式:
B中加入L的水溶液
G的水溶液中通入过量的H

10.(15分)下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素。已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:

(1)B的电子式为 ;
(2) 写出B和C反应的化学方程式 ;
(3)写出E与G的稀溶液的离子方程式,并标出电子转移数目:
;
(4)J、K均是同种金属的氯化物,且K为白色沉淀。写出SO2还原J生成K的离子方程式 ;
(5)汽车尾气中常含有D和CO ,二者在催化剂作用下可以大部分转化为两种对空气无污染的物质,已知: F(g) + A(g) = 2D (g) △H = +180.5KJ/mol
2C (s)+ O2 (g)= 2CO(g) △H = -221.0 KJ/mol
C (s)+ O2(g) = CO2(g) △H = -393.5 KJ/mol
则上述尾气转化的热化学方程式为: 。
|

(3) 3Cu +8H+ + 2NO3- = 3Cu2+ + 2NO + 4H2O
(4)2Cu2+ +2Cl-+ SO2 +2H2O = 2CuCl↓+ 4H+ + SO42-
 (5)2NO(g)+2CO(g) N2(g)+2CO2(g)△H= -746.5KJ/mol
(5)2NO(g)+2CO(g) N2(g)+2CO2(g)△H= -746.5KJ/mol
9.(15分)
(1)第二周期VIA族;O N Na(各2分,共4分)
|
 NH3·H2O+H+(2分)
NH3·H2O+H+(2分)
|
(4)1:1010(或10-10,10-10:1)(2分)
(5)14(3分)
8.(15分)(1)Na2O2(2分)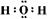 (2分)(2)Cl2+2OH-=Cl-+ClO-+H2O(2分)
(2分)(2)Cl2+2OH-=Cl-+ClO-+H2O(2分)
(3)4AlCl3+6Na2O2+6H2O=4Al(OH)3↓+12NaCl+3O2↑ (3分)
(4)阴极(2分),在阴极由于H+得到电子产生H2,破坏了水的电离平衡,促进水继续电离,导致溶液中c(OH-)>c(H+),溶液呈碱性,所以阴极附近溶液变为红色 (3分)
 9.(15分)下列物质有如下转化关系(有的生成物未列出),其中:D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质。
9.(15分)下列物质有如下转化关系(有的生成物未列出),其中:D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质。
A、B、C、D,E均由Q,R、x、T四种短周期元素中的两种或三种组成,且Q、R、X、T原子序数依次增大;X的最外层电子数是电子层数的3倍;R和X相邻;Q和T同主族,Q为非金属元素,T为金属元素。则:
(1)X在周期表中的位置是 ,R、X、T的原子半径从小到大的顺序为
(用元素符号表示);
(2)A和G等物质的量反应产物的水溶液显 性,其原因用离子方程式表示为 ;
(3)A和X2反应的化学方程式为 ;
(4)pH均为12的D溶液和F溶液中,水电离出的c(OH-)之比为 ;
(5)为保护环境,通过安装汽车尾气处理装置,使尾气中的E和CO反应转化为两种空气的成分,当反应转移l mol电子时,生成的气体在标准状况下的总体积为 L。
8. (15分)A-J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。
(15分)A-J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。
回答下列问题:
(1) B的化学式: ,
E的电子式_________。
(2)写出反应⑦的离子方程式 __________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式_____________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在_____________(填“阴、阳”)极附近溶液由无色变为红色,其原因是_________________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com