
题目列表(包括答案和解析)
23.(6分)为测定一种复合氧化物开发的磁性粉末材料的组成,称取12.52g样品,将其全部溶于过量稀硝酸后,配成100mL溶液。取其一半,加入过量K2SO4溶液,生成白色沉淀,经过滤、洗涤、烘干后得4.66g固体。在余下的50mL溶液中加入少许KSCN溶液,显红色;如果加入过量NaOH溶液,则生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20g固体。(1)计算磁性粉末材料中氧元素的质量百分含量。(2)确定该材料的化学式
22.(10分)一种用于治疗高血脂的新药灭脂灵是按如下路线合成的:
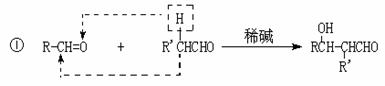 已知:
已知:
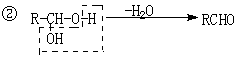
已知G的分子式为C10H22O3,试回答:
(1)写出结构简式:B E ;
(2)上述①-⑤反应中属于取代反应的是 (填序号);
(3)写出反应方程式:
Ⅰ、反应② ;
Ⅱ、反应⑤ ;
Ⅲ、F与银氨溶液反应: 。
21.(8分)有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到B(C4H4O4)和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。
(1) A可发生的反应有____________________(选填序号)。
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应
(2)B分子所含官能团的名称是__________、__________。
(3)B分子中没有支链,其结构简式是____________________,B的具有相同官能团的同分异构体的结构简式是____________________。
(4)由B制取A的化学方程式是____________________________________________。
(5)天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由B通过以下反应

天门冬氨酸的结构简式是____________________________________________。
20. 科学家对H2O2结构的认识经历了较为漫长的过程,最初,科学家提出了两种观点: ①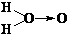 、②H-O-O-H。已知在化学反应中氧氧键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:
、②H-O-O-H。已知在化学反应中氧氧键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:
a.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
b.将生成的A与H2反应(已知该反应中H2作还原剂)。
(1)如果H2O2的结构如①所示,实验b中化学反应方程式为(A写结构简式,下同):
____________ _;假如H2O2的结构如②所示,则实验b中化学反应方程式为 :___________________ 。
(2)为了进一步确定H2O2的结构,还需在实验b后添加一步实验c,那么实验c中用到的药品名称为:_____________。
(3)通过研究,科学家在确定了H2O2结构为②的基础上,并进一步通过实验得出其具有弱酸性、氧化性等化学性质,也能够发生自偶电离。
其自偶电离的电离方程式是 ;
由于H2O2显弱酸性,在一定条件下它能同强碱作用生成正盐或酸式盐,请写出H2O2与Ba(OH)2反应生成正盐的化学方程式 ;
19.(1)配平下列离子反应方程式
Fe(OH)3 + ClO- + OH- → FeO4 n- + Cl- + H2O
(2)已知有10.7g Fe(OH)3参加反应,共转移了0.3NA个电子,则n = ,
FeO4n-中铁元素的化合价为 。
(3)根据前面的知识,推测FeO4 n-能和下列 (填序号)物质反应。
A、KMnO4 B、SO2 C、H2S D、O2
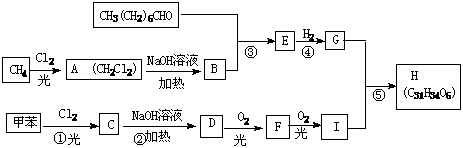
18.已知A-I均为短周期元素构成的物质,其中常温下B、F为固体单质,C、G为气体单质,D为无色液体。E的焰色反应为黄色。
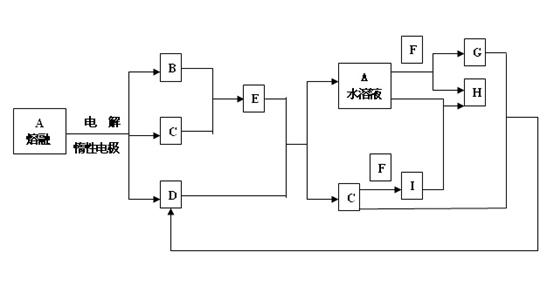
(1)E的电子式:_____________________,D的路易斯结构式:__________
(2)A B+C+D的化学方程式:________________________________________
B+C+D的化学方程式:________________________________________
(3)A+F G+H的离子方程式:______________________________________
G+H的离子方程式:______________________________________
(4)已知①F性质活泼,却能在空气中稳定存在。
②F的熔点为660℃; I的熔点为2050℃
若在酒精灯外焰上加热纯F的薄片(厚度为0.1mm), _____________________________________;
这种现象也说明了___________________________________________________;
若把F的粉状物洒到酒精灯火焰上,现象为_____________________________________。
(5)工业上制备F是通过电解熔融I(熔点高)得到的,而不通过电解熔融F的氯化物(熔点低)得到的,其理由是_____________________________________。
52.24g。
(5)数据处理,经计算,参加反应的碳元素质量为0.48g ,氧元素为0.96g。得出原假设不成立,理由是 。
 (6)得出结论:根据数据处理结果判断反应产生的气体是
,该实验中发生的化学方程式为
。
(6)得出结论:根据数据处理结果判断反应产生的气体是
,该实验中发生的化学方程式为
。
(7)实验优化:根据实验得出的结论,应对该实验装置进一步完善,你认为应作如何改
进? 。
17.某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进形研究。
(1)提出假设:该反应的气体产物全部是二氧化碳。
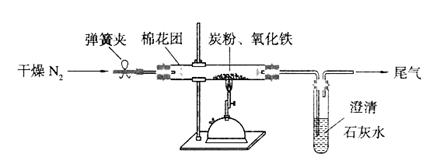 (2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
(2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
(3)查阅资料:氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式:
(4)实验操作及实验现象:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁与2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
④待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为
16.为了测定氢氧化钠固体混合物m g中碳酸钠的质量分数,甲、乙两位同学分别设计了如下的实验方案:
(I)甲同学的方案是:将样品溶解,加过量氯化钡溶液,过滤、洗涤、烘干,称量得固体n g。
(1)混合物中碳酸钠的质量分数为(用m、n表示) 。
(2)甲同学洗涤沉淀的操作是 。
(3)Ca2+、Ba2+ 都可以使CO32-沉淀完全,但使用氯化钡溶液比氯化钙溶液所得的结果具有更高的精确度,原因是:
① ;
② ;
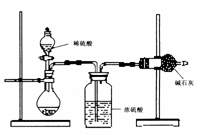 (II)乙同学的方案如图所示:
(II)乙同学的方案如图所示:
(1)根据乙同学的实验装置图分析,在每次实验中,完成测定过程至少要进行 次称量操作。
(2)他重复正确操作了三次,结果数据出现了较大的偏差,你认为主要原因可能是(任写三个):
① ;
② ;
③ 。
15.(1)下列有关实验操作说法中,正确的有 。
①容量瓶检漏的操作是:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置,观察是否漏水
②除去KCl溶液中的少量MgCl2,加入适量NaOH溶液,过滤
③分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④用碱式滴定管量取25.00mL溴水
⑤用瓷坩埚灼烧各种钠的化合物
⑥在进行过滤操作时,为了加快过滤速率,可用玻璃棒不断搅拌过滤器中液体
⑦实验中多取的试剂都不得放回原试剂瓶
(2) 碱式碳酸铜的制备方法很多,其最后一步操作都是相同的,即都需要过滤.但过滤装置的漏斗下端都连接了一个如下图所示的装置。这装置的作用是:________________。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com