
题目列表(包括答案和解析)
2、有关物质的用途叙述不正确的
A、碘化银、干冰均可用于人工降雨; B、皓矾、水玻璃均可做木材防腐剂
C、白磷、磷矿粉均可用于制磷酸 D、纯碱、小苏打均常用作洗涤剂
1、“飘尘”是物质燃烧时产生的粒状飘浮物,颗粒很小(直径小于10-7m)不易沉降(可飘浮数小时甚至数年)。它与空气中的SO2、O2等接触时,SO2会部分转化成SO3,使空气酸度增加,飘尘所起的主要作用是
A、氧化剂 B、还原剂 C、吸附剂 D、催化剂
9.(2010年北京)下列有关钢铁腐蚀与防护的说法正确的是
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是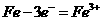
解析:钢管与电源正极连接,钢管做阳极被腐蚀,A错;钢管与铜管露天堆放在一起,可形成原电池,钢管做负极被腐蚀,C错;铁被腐蚀负极反应是:Fe-2e-=Fe2+,D错。
答案:B


 w_w w. k#s5_
w_w w. k#s5_
8.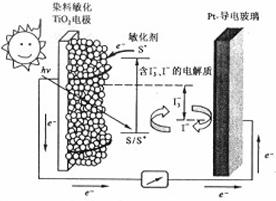 (2010年全国1)右图是一种染料敏化
(2010年全国1)右图是一种染料敏化
太阳能电池的示意图。电池的一个点极
由有机光敏燃料(S)涂覆在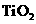 纳米
纳米
晶体表面制成,另一电极由导电玻璃镀
铂构成,电池中发生的反应为:w w. k#s5_
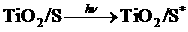 (激发态)
(激发态)
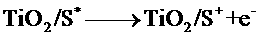
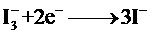
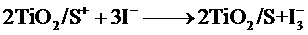
下列关于该电池叙述错误的是:
A.电池工作时,是将太阳能转化为电能
B.电池工作时,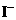 离子在镀铂导电玻璃电极上放电
离子在镀铂导电玻璃电极上放电
C.电池中镀铂导电玻璃为正极
D.电池的电解质溶液中I-和I3-的浓度不会减少
解析:B选项错误,从示意图可看在外电路中电子由负极流向正极,也即镀铂电极做正极,发生还原反应:I3-+2e-=3I-;A选项正确,这是个太阳能电池,从装置示意图可看出是个原电池,最终是将光能转化为化学能,应为把上面四个反应加起来可知,化学物质并没有减少;C正确,见B选项的解析;D正确,此太阳能电池中总的反应一部分实质就是:I3-
 3I-的转化(还有I2+I-
3I-的转化(还有I2+I- I3-,另一部分就是光敏有机物从激发态与基态的相互转化而已,所有化学物质最终均不被损耗!
I3-,另一部分就是光敏有机物从激发态与基态的相互转化而已,所有化学物质最终均不被损耗!
答案:B w w. k#s5_
7.(2010年安徽)某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2 + O2 == 2H2O,下列有关说法正确的是w w. k#s5_
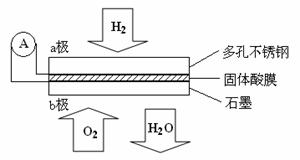
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2 + 2H2O + 4e- == 4OH-
C.每转移0.1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极
解析:还原剂在负极失电子,氧化剂在正极得电子,因此a 为负极,b为正极。电子从负极经外电路流向正极。因为这是酸性电解质,不可能生成OH-,正极反应:O2 +4H+ + 4e-== 2H2O;1.12L的H2没有指明状况不一定是0.05mol;原电池中阳离子向正极运动,因此D正确。
答案:D
6.(2010年江苏)右图是一种航天器能量
储存系统原理示意图。 下列说法正确的是W W W K S 5 U . C O M
A.该系统中只存在3种形式的能量转化
B.装置Y中负极的电极反应式为:w w. k#s5_

C.装置X能实现燃料电池的燃料和氧化剂再生
D.装置X、Y形成的子系统能实现物质的零排放,
并能实现化学能与电能间的完全转化
解析:本题主要考查的是电化学的有关知识。由装置图可知在该装置系统中,有四种能量转化的关系,即太阳能、电能、化学能和机械能之间的相互转化,A错误;装置Y应该为氢氧燃料电池,负极失去电子发生氧化反应,因此电极反应式为:H2 -2e- + 2OH- = 2H2O,B错误;装置X相对于电解池,只不过是太阳能提供能量来电解水,产生H2和O2,实现燃料(H2)和氧化剂(O2)的再生,所以C制取;在反应过程中,有能量的损耗和热效应的产生,不可能实现化学能和电能的完全转化,即选项D错误。综上分析可知,本题选C项。
答案:C[
5.(2010年福建)铅蓄电池的工作原理为: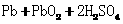 ====
====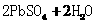
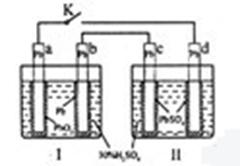 研读右图,下列判断不正确的是w w.
k#s5_
研读右图,下列判断不正确的是w w.
k#s5_
A.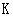 闭合时,d电极反应式:
闭合时,d电极反应式:
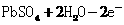 ====
====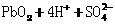
B.当电路中转移0.2 mol电子时,Ⅰ中
消耗的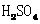 为0.2mol
为0.2mol
C.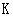 闭合时,Ⅱ中
闭合时,Ⅱ中 向c电极迁移
向c电极迁移
D.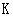 闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极w w. k#s5_
闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极w w. k#s5_
解析:本题考查电化学(原电池、电解池)的相关知识。K闭合时Ⅰ为电解池,Ⅱ为 电解池,Ⅱ中发生充电反应,d电极为阳极发生氧化反应,其反应式为PbSO4 + 2H2O
-2e- = PbO2 + 4H+ + SO42-
所以A正确。在上述总反应式中,得失电子总数为2e-,当电路中转移0.2mol电子时,可以计算出Ⅰ中消耗的硫酸的量为0.2mol,所以B对。K闭合一段时间,也就是充电一段时间后Ⅱ可以作为原电池,由于c表面生成Pb,放电时做电源的负极,d表面生成PbO2,做电源的正极,所以D也正确。K闭合时d是阳极,阴离子向阳极移动,所以C错。
电解池,Ⅱ中发生充电反应,d电极为阳极发生氧化反应,其反应式为PbSO4 + 2H2O
-2e- = PbO2 + 4H+ + SO42-
所以A正确。在上述总反应式中,得失电子总数为2e-,当电路中转移0.2mol电子时,可以计算出Ⅰ中消耗的硫酸的量为0.2mol,所以B对。K闭合一段时间,也就是充电一段时间后Ⅱ可以作为原电池,由于c表面生成Pb,放电时做电源的负极,d表面生成PbO2,做电源的正极,所以D也正确。K闭合时d是阳极,阴离子向阳极移动,所以C错。
 答案:C
答案:C
4.(2010年江苏)下列说法不正确的是w w. k#s5_
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应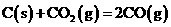 不能自发进行,则该反应的
不能自发进行,则该反应的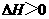
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中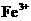 、
、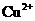 、
、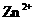 的氧化性依次减弱
的氧化性依次减弱
解析:本题主要考查的是有关的化学反应原理。铅蓄电池在放电过程中,负极反应为Pb-2e-+SO42-=PbSO4↓其质量是增加的,A错误;该反应
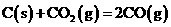 是典型的吸热反应,在常温下不能自发进行,B正确;催化剂能改变反应速率,但不一定加快,最重要的是它不能改变化学平衡状态,即不能改变转化率,C错误;由反应Cu+2Fe3+=Cu2++2Fe2+可知
是典型的吸热反应,在常温下不能自发进行,B正确;催化剂能改变反应速率,但不一定加快,最重要的是它不能改变化学平衡状态,即不能改变转化率,C错误;由反应Cu+2Fe3+=Cu2++2Fe2+可知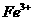 的氧化性大于
的氧化性大于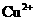 ,由金属活动顺序表可知Cu2+氧化性大于Zn2+的。综上分析可知,本题选A、C项。
,由金属活动顺序表可知Cu2+氧化性大于Zn2+的。综上分析可知,本题选A、C项。
答案:A、C
3.(2010年浙江)Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe。有关该电池的下列说法中,正确的是w w. k#s5_
A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的电池反应式为:2Li+FeS=Li2S+Fe
C.负极的电极反应式为Al-3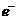 =Al3+
=Al3+
D.充电时,阴极发生的电极反应式为:Li2S+Fe-2e- =2Li++FeS
解析:Li和Al都属于金属,所以Li-Al应该属于合金而不是化合物,因此化合价为0价,错误;由正极反应式知负极应该是Li失去电子而不是Al,属于选项C错误,B正确;充电时阴极相当于原电池得负极,要得电子,正确的反应式是2Li++2e-=2Li,所以选项D也错误。
答案:B
2.(2010年海南)利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是w w. k#s5_
A. 电解时以精铜作阳极
B.电解时阴极发生还原反应
C.粗铜连接电源负极,其电极反应是Cu =Cu2+ + 2e-
D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
解析:本题主要考察电解原理及其应用。利用电解法进行粗铜提纯时粗铜应作阳极,精铜作阴极;阳极与电池的正极相连发生氧化反应,阴极与电池的负极相连发生还原反应;这几种金属的活动性顺序为Zn>Fe>Cu>Ag>Pt,因此在电解过程中Ag、Pt不会失去电子,而是形成阳极泥。所以选项B、D正确。
答案:B、D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com