
题目列表(包括答案和解析)
13.pH=11的X、Y两种碱溶液各10ml,分别稀释至1000ml,此时pH(Y)>pH(X),下列说法中正确的是( )
A.若X、Y两种碱溶液都是一元碱,则X、Y两种溶液的物质的量浓度一定相等
B.稀释后X溶液中水电离的c(H+)比Y溶液中水电离的c(H+)小
C.若稀释后两溶液的9<pH<11,则X、Y都是弱碱
D.完全中和X、Y两溶液时,消耗同浓度盐酸的体积V(X)>V(Y)
12.设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.足量Na2O2和44gCO2反应,转移电子数目为NA
B.常温常压下,11.2L氧气所含的原子数为NA
C.1L 1mol/L醋酸溶液中离子总数为2NA
D.46 g NO2 和 N2O4混合气体中含有原子数小于3NA
11.在某一容积为2 L的密闭容器内,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)
+H2O (g) 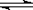 CO2(g) + H2(g);ΔH=a kJ/mol。
CO2(g) + H2(g);ΔH=a kJ/mol。
反应达到平衡后,测得c(CO):c(CO2)= 3:2。下列说法正确的是 ( )
A.判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等
B.反应放出的热量为0.04 a kJ
C.平衡时H2O 的转化率为40%
D.若将容器的体积压缩为1 L,有利于该反应平衡正向移动
10.下列各项是某同学所做实验及根据现象所得出的结论,其中正确的是( )
A.电解质在水溶液中发生的离子反应一定是复分解反应
B.向某溶液能滴加FeCl3溶液,溶液变紫色,说明该溶液中含有酚类物质
C.某气体能使湿润的淀粉碘化钾试纸变蓝,说明该气体是Cl2
D.一种强氧化剂和一种强还原剂混合肯定会发生氧化还原反应
9.(改编)某学生设计了如图所示的方法,鉴定盐A的组成成分,由此分析,下列结论中,正确的是( )

A.A中一定有Fe3+ B.C中一定有Fe3+
C.B为AgI沉淀 D.A一定为FeI3溶液
32.(8分)1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家,O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构呈V型,键角116.5o,三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子。请回答: (1)臭氧与氧气的关系是 : 。 (2)下列物质的分子与O3分子的结构最相似的是 。 A. H2O B. CO2 C. SO2 D. BeCl2 (3)分子中某1原子有1对没有跟其它原子共用电子叫孤对电子,那么O3分子有 对孤对电子。 (4)O3分子是否(是or否) 为极性分子
(5)O3与O2间的转化是否为氧化还原反应 (若否,请回答A小题;若是,请回答B小题) A .O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平: PbS + O3 - PbSO4 + O2 B .O3在催化剂作用生成1molO2转移电子数 mol.
(6)臭氧分子中非极性共价键是 键,特殊的化学键是 键。
化学与技术模块
化学有机选模块
31. (8分)芬必得是一种高效的消炎药物,其主要成分为布洛芬,它有多种合成路线,下面是一种合成方法:

已知:卤代烃有如下反应:R-Cl + NaCN → R-C≡N + NaCl回答下列问题:
(1) 写出有机物B的结构简式: ;
(2)写出反应A→B和B→C的反应类型(可供选择的反应类型有:取代、加成、消去、加聚、缩聚):
|
反应 |
A→B |
B→C |
|
反应类型 |
|
|
(3) 有机物C和苯酚的关系是( )(填选项字母)。
A.互为同分异构体 B.互为同系物
C.均属于芳香醇类 D.均属于芳香族化合物
(4) 与A具有相同的分子式,且苯环上只有一个取代基的有机物共有四种,写出除A外的其余三种的结构简式(写出两种即可得满分):
; ; 。
(5) 写出E→布洛芬反应的化学方程式(要求配平,有机物要用结构简式表示):
。
物质结构与性质模块
30.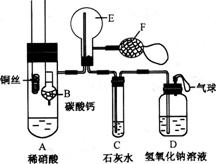 (16分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(16分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先出去其中的空气。其中第一步实验操作为:___________________________________。如何确定E中空气已被赶尽:______________________________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子反应方程式为 。
(3)如何证明E中收集到的是NO而不是H2?
______________________________________________________________。
一段时间后,C中白色沉淀溶解,其原因是____________________________ ____
(4)装置D的作用是__________________________________________________。
29.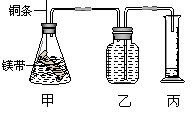 (14分)某课外学习小组设计如下的简易实验装置,证明在相同条件下,体积相同、物质的量浓度也相同的两种强弱不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定该实验条件下的气体摩尔体积。请回答下列问题:
(14分)某课外学习小组设计如下的简易实验装置,证明在相同条件下,体积相同、物质的量浓度也相同的两种强弱不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定该实验条件下的气体摩尔体积。请回答下列问题:
⑴请将该实验的主要操作步骤补充完整:
①配制浓度均为 1 mol·L-1的盐酸和醋酸溶液;
②用 量取10.00 mL 1 mol·L-1的盐酸和醋酸分别移入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带 ag,并系于铜条末端,a的数值要大于 ;
④在广口瓶中装满水,按图连接好装置并检查装置的气密性;
⑤将铜条向下移动,使足量的镁带浸入酸中(铜条不与酸接触),至反应完全后,记录下 ;
⑥反应结束后,读取量筒中水的体积为V mL(包括导管中的水)。
⑵要比较准确地读取量筒内水的体积,必须包括以下几个步骤:①使乙、丙中液面相平;②将气体冷却至室温;③平视读取量筒内水的体积。其操作的正确顺序是 。(用序号排列)
⑶该实验中应该选用 规格的量筒。(填序号)
A. 100 mL B. 200 mL C. 500 mL
⑷若不考虑水蒸气的影响,在该实验室条件下,气体摩尔体积的计算式为 。若仰视读取量筒内水的体积,则测得气体摩尔体积将 (填偏大、偏小或不变)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com