
题目列表(包括答案和解析)
化学有机选模块
31.(8分)(1)化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化:

①A分子中的官能团名称是 ;
②A只有一种一氯取代物B。写出由A转化为B的化学方程式
;
③A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。
F的结构简式是 。
(2)化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与氯化铁溶液发生显色反应。“HQ”还能发生的反应是(选填序号) 。
①加成反应 ②氧化反应 ③加聚反应 ④水解反应
“HQ”的一硝基取代物只有一种。“HQ”的结构简式是 。
(3)A与“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”。“TBHQ”与氢氧化钠溶液作用得到化学式为C10H12O2Na2的化合物。“TBHQ”的结构简式是 。
物质结构与性质模块
30.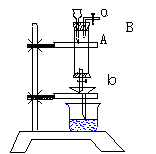 (16分)三氯化铁是中学化学实验中必不可少的重要试剂,某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如右图所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中滴加过量盐酸,此时溶液显浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿中加热,蒸发掉部分水并使多余的HNO3分解,再降温结晶得FeCl3·6H2O晶体,请填写下列空白:
(16分)三氯化铁是中学化学实验中必不可少的重要试剂,某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如右图所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中滴加过量盐酸,此时溶液显浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿中加热,蒸发掉部分水并使多余的HNO3分解,再降温结晶得FeCl3·6H2O晶体,请填写下列空白:
(1)从B导管收集产生的气体可采用的方法是________________ _____。
(2)滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是 _______。
(3)烧杯内放过量稀HNO3的原因是① ② ,离子方程式为 。
(4)整个实验过程中,活塞开关a都必须打开,原因之一是产生H2及时排出,之二是_____________________________之三是________________________________。
(5)用降温结晶的方法制得FeCl3·6H2O,而不用直接蒸干的方法来制得晶体的理由是___________________________________________________。
29. (12分)下图是某同学设计的NH3催化氧化并检验反应生成的酸性物质的简易装置(图中必要的铁架台、铁夹、微型酒精灯等均已略去)。已知:NO2+NO+2NaOH=2NaNO2+H2O。实验中所选用的试剂不超出下列范围,且不得重复使用。
(12分)下图是某同学设计的NH3催化氧化并检验反应生成的酸性物质的简易装置(图中必要的铁架台、铁夹、微型酒精灯等均已略去)。已知:NO2+NO+2NaOH=2NaNO2+H2O。实验中所选用的试剂不超出下列范围,且不得重复使用。
①NH4Cl和Ca(OH)2的混合物;②浓氨水;③NaOH固体;④KClO3和MnO2的混合物;
⑤6mol/LNaOH溶液;⑥0.5moL/LNaOH溶液;⑦酚酞试液;⑧碱石灰;⑨浓H2SO4;
⑩CuO。
试回答下列问题:
(1)叉形管中液态物质A是(填代号) ,固体物质B是(填代号) ;
(2)C处发生反应的化学方程式是 ;
(3)混合物D是为了检验酸性物质的生成而放入的,其组成是(填代号) ,实验
过程中的现象是:
(4)E处球形玻璃管的作用是 ;
(5)F处的棉花应蘸取的物质是(填代号) ,其作用是
28.(14分)蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下
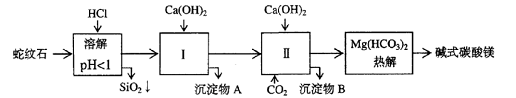
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
(1) 蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是________
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见右表)
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致_________溶解、_________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_________ (填入物质的化学式),然后__________________________________ (依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是_______ (填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量 ②高温分解 ③___________________④_________________ ⑤MgO称量
(6)18.2g产品完全分解后,产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中:
a=_________ b =_________ c =_________
15.甲、乙两容器都发生反应2A(g)+B(g)  xC(g),两容器温度和初始压强相同。甲容器中充入2molA和1molB,达平衡后,C在平衡混合气中的体积分数为
xC(g),两容器温度和初始压强相同。甲容器中充入2molA和1molB,达平衡后,C在平衡混合气中的体积分数为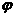 、物质的量为n1;乙容器中充入1.4molA、0.7molB和0.6molC,达平衡后C在平衡混合气中的体积分数为
、物质的量为n1;乙容器中充入1.4molA、0.7molB和0.6molC,达平衡后C在平衡混合气中的体积分数为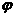 、物质的量为n2。下列说法中正确的是( )
、物质的量为n2。下列说法中正确的是( )
A.若甲、乙两容器均为恒压容器,则x必等于2
B.若甲、乙两容器均为恒压容器,则x必等于3
C.若甲为恒压容器、乙为恒容容器,且x≠3,则n1必大于n2
D.若甲为恒容容器、乙为恒压容器,且x=3,则n1必大于n2
第II卷 非选择题 必做题部分
14.下列说法正确的是( )
A.食盐和冰醋酸的熔化克服相同类型作用力 B.苯和苯酚可以用分液法分离
C.铅笔芯的主要成分是金属铅 D.臭氧层的破坏对人类健康有害
13.把50mL2mol·L-1的NaOH溶液、100mL1mol·L-1的H2SO4溶液以及40mL3mol·L-1 的氨水混合,所得溶液使酚酞溶液呈浅红色,下列说法正确的是( )
A.混合后,溶液中水的电离是被促进的
B.混合后,溶液中的溶质有两种
C.混合后,体系中铵根水解程度大于氨水的电离程度
D.混合后,溶液中离子浓度关系为:[NH4+] > [SO42-] = [Na+] >[OH-] > [H+]
12. A、B、C短周期元素在周期表中的位置如右图所示,已知A、C可分别与B形成化合物x和y,A与B的质子数之和为C的质子数。现有以下说法,其中判断正确的组合为( )
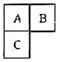 ①B与C均存在同素异形体
②x的种类比y的多
①B与C均存在同素异形体
②x的种类比y的多
③常温下,B的氢化物中无H+④C的最高价氧化物对应水化
物能与A的氢化物形成三种盐
A.①②③④ B.②④ C.①②④ D.①②
11.在硫酸铁溶液中,加入a g铜,完全溶解后,又加入b g铁,充分反应后得到 c g残余固体,且b<c ,则下列判断正确的是( )
A.最后得到的溶液中含有Fe3+ B.残余固体可能为铁、铜混合物
C.最后得到的溶液中含Cu2+ D.残余固体一定全部是铜
10.下列除去物质中杂质的方法,正确的一组是( )
①用渗析的方法除去葡萄糖溶液中的少量NaCl
②用氢氧化钠溶液除去苯中的少量苯酚
③用直接加热的方法除去NaHCO3固体中的少量I2
④通过灼热的氧化铜除去CO中的少量CO2
⑤滴加适量的氢氧化钠溶液除去NaCl溶液中的FeCl3
A.①② B.②⑤ C.①③④ D.②③⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com