
题目列表(包括答案和解析)
1.根据化学反应A+B==C+D中,某学生作了如下四种叙述:①若mgA与B充分反应后生成ngC和wgD,则参加反应的B的质量为(m+n-w)g;②若mgA和ngB完全反应,生成的C和D的总质量是(m+n)g;③若取A、B各mg,则反应生成C和D的质量总和不一定是2mg;④反应物A、B的质量比一定等于C、D的质量比 ( )
A. ①②③ B. ②③④ C. ①④ D. ②③
[例7] 将4g甲烷和适量氧气混合后通入一密闭容器中,点燃使之恰好完全反应,待恢复到原温度后,测得反应前后压强分别为3.03×105Pa和1.01×105Pa,同时又测得反应共放出222.5kJ热量。试根据上述实验数据,写出该反应的热化学方程式。
[解析]书写热化学方程式有两个注意事项:一是必须标明各物质的聚集状态,二是注明反应过程中的热效应(放热用“+”,吸热用“-”)。要写本题的热化学方程式,需要解决两个问题,一是水的状态,二是反应过程中对应的热效应。由阿伏加德罗定律的推论可知: ,根据甲烷燃烧反应的化学方程式可知,水在该状态下是液体(想一想,如为气体则反应前后的压强比应为多少?),因4g甲烷燃烧时放出222.5kJ热量,则1mol甲烷燃烧时放出的热量为
,根据甲烷燃烧反应的化学方程式可知,水在该状态下是液体(想一想,如为气体则反应前后的压强比应为多少?),因4g甲烷燃烧时放出222.5kJ热量,则1mol甲烷燃烧时放出的热量为 。
。
本题答案为:CH4(气)+2O2(气)==CO2(气)+2H2O(液)+890kJ
4.实战演练
[例6]1体积SO2和3体积空气混合后,在450℃以上通过V2O5催化剂发生如下反应:2SO2(气)+O2(气)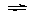 2SO3(气),若在同温同压下测得反应前后混合气体的密度比为0.9:1。则反应掉的SO2是原有SO2的___________%。
2SO3(气),若在同温同压下测得反应前后混合气体的密度比为0.9:1。则反应掉的SO2是原有SO2的___________%。
[解析]由阿伏加德罗定律的推论可知: ,V2=0.9×(3+1)=3.6体积。
,V2=0.9×(3+1)=3.6体积。
设参加反应的SO2为x体积,由差量法
2SO2
+ O2 2SO3 ΔV
2SO3 ΔV
2 3-2=1
x 4-3.6=0.4
2:1=x:0.4 解得x=0.8体积,所以反应掉的体积是原有SO2的 。
。
[例5]在某温度时,一定量的元素A的氢化物AH3在一定体积密闭容器中可完全分解成两种气态单质,此时压强增加了75%。则A单质的一个分子中有_______个A原子,AH3分解反应的化学方程式为__________________________________________。
[解析]由阿伏加德罗定律的推论:相同温度和压强时,p1/p2=N1/N2得反应前后气体的分子数之比为1:1.75=4:7,可理解为反应式左边气体和反应式右边气体系数之和的比为4:7,再按氢原子守恒不妨先将反应式写为4AH3==A( )+6H2,再由A原子守恒得A右下角的数字为4。
本题答案为:4,4AH3==A4+6H2。
[例4]在一定条件下,有aLO2和O3的混合气体,当其中的O3全部转化为O2时,体积变为1.2aL,求原混合气中O2和O3的质量百分含量。
[解析]由阿伏加德罗定律,结合化学方程式的意义可知,化学方程式中气体化学式的系数比等于其体积比,所以此题实际上用阿伏加德罗定律的应用题。
设混合气体中O3占xL,则O2为(a-x)L
2O3 ==== 3O2
2L 3L
xL (3/2)xL
(3/2)x+(a-x)=1.2a,解得x=0.4a
根据阿伏加德罗定律:n(O3):n(O2)=V(O3):V(O2)=0.4a:0.6a=2:3
w(O2)= =50% , w(O2)=1-50%=50%。
=50% , w(O2)=1-50%=50%。
[例3]下列说法正确的是(NA表示阿伏加德罗常数)
A. 标准状况下,以任意比例混合的甲烷和丙烷混合物22.4L,则所含有的分子数为NA
B. 标准状况下,1L辛烷完全燃烧后,所生成气态产物的分子数为
C. 常温常压下,活泼金属从盐酸中置换出1molH2时发生转移的电子数为2NA
D. 常温常压下,1mol氦气含有的核外电子数为4NA
[解析]阿伏加德罗定律所述的气体包括混合气体。标准状况下,22.4L混合气体所含有的分子数为NA,所以选项A正确。标准状况下,辛烷是液体,不能使用标准状况下气体的摩尔体积22.4L/mol这一量,所以1L辛烷的物质的量不是1/22.4mol,选项B错误。每生成1molH2时必有2molH+获得2mol电子,即转移电子数为2NA,选项C正确。1个氦原子核外有4个电子,氦气是单原子分子,所以1mol氦气含有4mol电子,这与外界温度和压强无关,所以选项D正确。本题正确答案为AC。
[例1]有一在空气里暴露过的KOH固体样品,经分析其含水7.65%,含K2CO34.32%,其余是KOH。若将ag样品放入bmL1mol/L的盐酸中,使其充分作用后,残酸用25.25mLcmol/L的KOH溶液恰好中和完全。蒸发所得溶液,得到固体质量的表达式中(单位g)
A. 只含有a B. 只含有b C. 必含有b D. 一定有a、b和c
[解析]本题如使用Cl原子守恒的方法可大大简化解题步骤。由题意,反应后溶液为KCl溶液,其中的Cl-来自盐酸,所以所得KCl固体的物质的量与HCl的物质的量相等,即为0.001bmol,质量为0.0745bg。如果解题时使用ag这个数据,也能获得答案,此时答案中也会含有b,请读者自行解答。
本题正确答案为C。
[例2]在一定条件下,16gA和22gB恰好反应生成C和4.5gD。在相同条件下,8gA和15gB反应可生成D和0.125molC。从上述事实可推知C的式量为____________。
[解析]根据质量守恒定律,当16gA与22gB恰好反应生成4.5gD的同时,生成C的质量应为16+22-4.5=33.5g,当8gA和15gB反应时,根据判断B是过量的,A与C的质量关系应是16:33.5=8:x,x=16.75g,MC=16.75g/0.125mol=134g/mol,即C的式量为134。
3. 例题精讲
物质的量是以阿伏加德罗常数来计量的,0.012kg碳-12所含的碳原子数就是阿伏加德罗常数(NA)。6.02×1023是它的近似值。
注意:叙述或定义摩尔时一般用“阿伏加德罗常数”,在具体计算时常取“6.02×1023”。
3.知知网络
 ①、定义:表示含有一定数目粒子的集体。
①、定义:表示含有一定数目粒子的集体。
②、符号:n
 物质的量 ③、单位:摩尔、摩、符号mol
物质的量 ③、单位:摩尔、摩、符号mol
④、1mol任何粒子(分、原、离、电、质、中子)数与0.012kg12C中所含碳原子数相同。
⑤、、架起微观粒子与宏观物质之间联系的桥梁。
 ①、定义:1mol任何粒子的粒子数叫阿伏加德罗常数。
①、定义:1mol任何粒子的粒子数叫阿伏加德罗常数。
阿伏加德罗常数: ②、符号NA
③、近似值:6.02×1023
 ①、定义:单位物质的量气体所占的体积叫~
①、定义:单位物质的量气体所占的体积叫~
基本概念 气体摩尔体积:②、符号:Vm
③、单位:L·mol-1
 ①、定义:单位物质的量物质所具有的质量叫~
①、定义:单位物质的量物质所具有的质量叫~
摩尔质量:②、符号:M ③、单位:g·mol-1或kg·mol-1
④、若以g·mol-1为单位,数值上与该物质相对原子质量或相对分子质量相等。
 ①、定义:单位体积溶液中所含溶质B的物质的量来表示溶液组成的物理量叫溶质B的物质的量浓度。
①、定义:单位体积溶液中所含溶质B的物质的量来表示溶液组成的物理量叫溶质B的物质的量浓度。
物质的量浓度:②、符号:c(B)
③、单位:mol·L-1
 ①、定律:在相同温度和压强下,相同体积的作何气体都含有相同数目的分子。
①、定律:在相同温度和压强下,相同体积的作何气体都含有相同数目的分子。
 同温同压下:
同温同压下: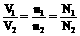
 ②、推论: 同温同压下:
②、推论: 同温同压下:
同温同体积下:
 Ⅰ、气体休的密度和相对密度:
Ⅰ、气体休的密度和相对密度:
标况下: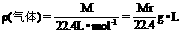
 A气体对B气体的相对密度:
A气体对B气体的相对密度:
Ⅱ、摩尔质量M(或平均摩尔质量 )
)
M=22.4L·mol-1×ρ,
 =M(A)ф(A)+M(B)ф(B)+··· ф为体积分数。
=M(A)ф(A)+M(B)ф(B)+··· ф为体积分数。
2.推论:
⑴同温同压下,V1/V2=n1/n2 ⑵同温同体积时,p1/p2= n1/n2=N1/N2
⑶同温同压等质量时,V1/V2=M2/M1 ⑷同温同压同体积时,W1/W2=M1/M2=ρ1/ρ2
注意:①阿伏加德罗定律也适用于不反应的混合气体。②使用气态方程PV=nRT有助于理解上述推论。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com