
题目列表(包括答案和解析)
11.(15分)(1)①CO2(g)+3H2(g)=== CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol(3分)
②O2 + 4H+ + 4e- =2 H2O (2分) 正 (2分)
③4.2×10-7 mol·L-1 (3分)
④> (1分) 因为既存在 HCO3-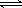 CO32-+H+ 也存在HCO3-+H2O
CO32-+H+ 也存在HCO3-+H2O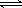 H2CO3+OH-、而HCO3-的水解程度大于电离程度 (2分)
H2CO3+OH-、而HCO3-的水解程度大于电离程度 (2分)
⑤Ba(OH)2(或NaOH溶液和BaCl2溶液) (2分)
(2)甲:负(1分); 2H++2e-→H2↑(1分);Cl2+2OH===Cl-+ClO-+H2O(2分)
 乙:I.①>(1分);ClO-+H2O HClO+OH- (2分) ②A、D(2分)
乙:I.①>(1分);ClO-+H2O HClO+OH- (2分) ②A、D(2分)
III.①钢钉表面有红褐色物质生成(1分)
②ClO-+2e-+H2O→Cl-+2OH-(2分)
10、(14分) (1)  (2分)
(2分)
(2)  (2分)
(2分)
(3)阴极: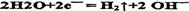 (2分)(写成2H+ +2e- = H2 ↑也给分)
(2分)(写成2H+ +2e- = H2 ↑也给分)
阳极: (2分) KOH (2分)
(2分) KOH (2分)
(4) 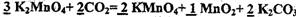 (2分) 0.75 mol·L-1 (2分)
(2分) 0.75 mol·L-1 (2分)
9.答案:氯碱工业
过量BaCl2、过量Na2CO3、过量NaOH、适量HCl 10x+y-14、>

(3)XS+2e-=Sx2- 13
8.(每空2分,共12分)
(1)①O2+2H2O+4e-→4OH-
|
②2Cl-+2H2O====2OH-+H2↑+Cl2↑
③5Cl2+I2+6H2O=10HCl+2HIO3
(2)①Fe→Fe2++2e-
②CuO(或CuCO3) 0.8(或1.24)
1.D 2.B 3.C 4.B 5.A 6 .D 7.D
10、 (14分)KMnO4是一种常用的强氧化剂,工业上可以以软锰矿(主要成分Mn02)为原料,通过液相法生产。即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再用铂板作阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:
(14分)KMnO4是一种常用的强氧化剂,工业上可以以软锰矿(主要成分Mn02)为原料,通过液相法生产。即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再用铂板作阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:
回答下列问题:
(1)写出反应器中反应的方程式
(2)生产过程中最好使用含MnO2 80%以上的富矿,因为MnO2含量最低的贫矿中Al的氧化物含量较高,会导致KOH消耗量偏高,用离子方程式表示KOH消耗偏高的原因 。
(3)写出电解槽中阴极和阳极的电极反应方程式 阴极: ;
阳极: 。
在电解法中循环I、II中利用的共同物质是 。
(4)在传统工艺中,得到K2MnO4后,向其中通入CO2制备KMnO4,配平方程式:
K2MnO4 + CO2 = KMnO4 + MnO2+ K2CO3
将所得KMnO4配成0.1 mol·L-1 KMnO4溶液,滴定20.00mL未知浓度的FeCl2溶液,消耗KMnO4溶液30.00mL,则FeCl2溶液的浓度为 mol/L。
9.(14分)已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):
A+B  M+D+E;E+M=A+F+B请回答:
M+D+E;E+M=A+F+B请回答:
⑴若A是一种钠盐,该反应是化学工业上制取单质E和化合物M的重要方法。该化学上工业称为 (选填:硫酸工业 氯碱工业 塑料工业),化学工业上电解A、B混合物时要使用下列试剂(NaOH 、Na2CO3、HCl、BaCl2)除去Ca2+、Mg2+、Fe3+、SO2_4等干扰离子,试剂的添加顺序依次为(用最简洁的语言如:过量、适量描述用量要求):
在25℃,pH=x的盐酸aL与pH=y的M溶液bL恰好中和(x≤6、y≥8)。x+y>14,则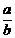 =
;(用x、y表示)且a
b(“>”“<”“=”)
=
;(用x、y表示)且a
b(“>”“<”“=”)
⑵若A是一种含氧酸盐,可用于实验室中检验乙醇中水的存在.该反应中电极上会析出红色固体。则其电解反应方程式是: 。
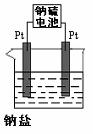
 (3)现有有一种新型的高能电池--钠硫电池(熔融的钠、硫为两极,以Na+导电的β-Al2O3陶瓷作固体电解质),反应式为:
(3)现有有一种新型的高能电池--钠硫电池(熔融的钠、硫为两极,以Na+导电的β-Al2O3陶瓷作固体电解质),反应式为:
2Na+xS Na2Sx,
用该电池作电源电解(如右图)含有 0.2mol上述⑴题中A盐溶液500ml时,若此电池工作一段时间后消耗23g Na 。则原电池的正极反应为 ;
电解后溶液加水稀释至2L,溶液的pH为 。
7. 化学实验小组在学习化学电源和氯碱工业相关知识后,在实验室
进行实验验证,他们设计组装了如下图所示装置,已知
化学实验小组在学习化学电源和氯碱工业相关知识后,在实验室
进行实验验证,他们设计组装了如下图所示装置,已知 为石墨电极;
为石墨电极; 为铁电极;
为铁电极; 为铝电极(已除去表面氧化膜);
为铝电极(已除去表面氧化膜);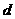 为多孔石墨电极,烧杯中是足量饱和食盐水(滴有酚酞),连好导线后,电流计指针发生明显偏转。下列判断正确( )
为多孔石墨电极,烧杯中是足量饱和食盐水(滴有酚酞),连好导线后,电流计指针发生明显偏转。下列判断正确( )
A. 为负极,
为负极,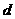 为阳极
为阳极
B.一段时间后, 和
和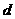 电极附近溶液变红
电极附近溶液变红
C. 电极电极反应式为:2Cl-2e-=Cl2↑
电极电极反应式为:2Cl-2e-=Cl2↑
D.当电解一段时间,B中出现大量白色沉淀时,停止
实验,再将A中溶液倒入B中混合,充分振荡,
沉淀全部消失
 8.(12分)如图甲、乙是电化学实验装置。
8.(12分)如图甲、乙是电化学实验装置。
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为 ;
②乙中总反应的离子方程式为 ;
③将湿润的淀粉KI试纸放在乙烧杯上方,
发现试纸先变蓝后褪色,这是因为过量的Cl2
氧化了生成的I2。若反应中Cl2和I2的物质的量
之比为5:1,且生成两种酸,该反应的化学方程式为 。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为 ;
②如果起始时乙中盛有200mLpH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入 (填写物质的化学式) g。
6. 有关右图所示原电池的叙述不正确的是( )
A.电子沿导线由Cu片流向Ag片
B.正极的电极反应是Ag++e-=Ag
C.Cu片上发生氧化反应,Ag片上发生还原反应
D.用该电池电解饱和食盐水,3.2 g Cu溶解时生成1.12 L Cl2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com