
题目列表(包括答案和解析)
27.复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺:
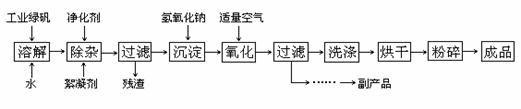
已知:① 工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3→ Fe3O4·4H2O
请回答下列问题:
(1)铁的常见氧化物有 ;
(2)Fe3O4与稀硝酸反应的离子方程式是 ,检验反应后的溶液中含Fe3+的方法 ;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是 ;
(4)生产中可获得的副产品是 ,提取该副产品的操作顺序是 (填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为
m3/h(假设反应在标准状态下进行,空气中O2占20%)。
26.某课外学习小组的同学设计了如图的装置,以验证SO2的氧化性、还原性和漂白性。

回答以下问题:
(1)单独检查装置C的气密性的操作是,关闭活塞b,然后________________________ ,
若发现________________,说明装置C气密性良好。
(2)用Na2SO3固体和硫酸溶液制取SO2气体,应选用__________(选“A”或“C”)做气体发生装置,不选用另一装置的理由是 。
小组同学发现产生气体的速率缓慢,可能的原因是___________________ 。
(3)小组的同学在A、C装置中的另一个用FeS固体和稀硫酸制取H2S气体,反应的方程式为_________________ 。
(4)SO2气体通过D装置时现象是____________________ ,通过E装置时现象是
________________ ;SO2与H2S在B装置中反应,现象是______________________。
(5)F仪器的名称是___________;F中盛有碱石灰,其作用是______________________。
25.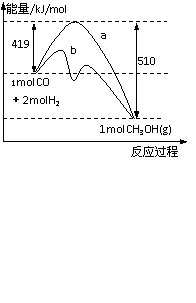 工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)  CH3OH(g),右图表示该反应进行过程中能量的变化。
CH3OH(g),右图表示该反应进行过程中能量的变化。
(1) 该反应平衡常数K的表达式为______________,温度降低,平衡常数K_________(填“增大”、“不变”或“减小”);
(2) b表示使用催化剂后的能量变化,写出反应的热化学方程式______________________;
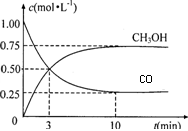
(3)在体积为2L的密闭容器中,充入2molCO和4molH2,
测得CO和CH3OH(g)的浓度随时间变化如右图所示。从
反应开始到平衡,用氢气浓度变化表示的平均反应速率
v(H2)=_____________;
(4)恒容条件下,下列措施中能使 增大的有______。
a.升高温度; b.充入He(g) c.再充入1molCO和2molH2 d.使用催化剂
24.已知在稀硫酸中,KBrO3和KI能发生以下反应(均未配平):
BrO3-+H++I-→IO3-+Br2+ H2O、 IO3-+H++Br-→ Br2 + I2+ H2O
(1)试比较在酸性条件下BrO3-、Br2、IO3-、I2 氧化性的强弱: > > > 。
(2)配平下列反应的离子方程式:
I-+ BrO3-+ H+→ I2+ Br-+ H2O
反应中的氧化剂是 ;被氧化的元素是 。
(3) 在稀硫酸中,若KI和KBrO3按物质的量之比6:1.1反应,生成的产物是H2O、 、 、
(用化学式或离子符号表示)。
23. 四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
|
元素 |
T |
X |
Y |
Z |
|
性质 结构 信息 |
原子的M电子层有2个成单电子 |
是地壳中含量最多的金属元素 |
原子核外s电子总数等于p电子总数;人体内含量最多的元素,且其单质是常见的助燃剂。 |
失去第1、第2、第3个电子消耗的能量分别为(单位相同) 5.4 75.6 122.5 |
(1) X的最高氧化物的水化物的电离方程式为 ;若在湿的纸漏斗中放有X的单质与铁的氧化物的混合物,表面放有一些氯酸钾,用镁带引燃,纸漏斗下方盛砂的蒸发皿中的现象是 。
(2) Z元素的原子失去第2个电子比失去第1电子消耗的能量大得多,其原因是
。
(3)若T的氧化物坚硬难熔,则T原子最外层外电子排布式为 ;T的气态氢化物的是否稳定 ;若T的单质易溶于CS2,则固态的该单质的晶体类型属于 晶体。
(4) 元素Y与氟元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (选填序号)。
a.常温下氟气的颜色比Y单质的颜色深 b.氟气与Y的氢化物剧烈反应,产生Y的单质
c.氟与Y形成的化合物中Y元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目
22.将2.4g Fe、Mg合金投入到一定量的稀硝酸中,金属与硝 酸 恰好完全反应,共收集到标准状况下的气体VL(硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、灼烧后称量,质量为3.6g。则收集到的气体体积V的值不可能为
A.2.24 B.1.68 C.1.00 D.0.986
第Ⅱ卷 (共84分)
21.250C时,将一定量的冰醋酸(即无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示。则下列说法错误的是
A.醋酸的电离度:a<b<c
 B.从a点到c点, c (CH3COO-)由大变小
B.从a点到c点, c (CH3COO-)由大变小
C.从a点到c点, n(CH3COO-)由小变大
D.从b点到c点,溶液中的比值减小
19.工业合成氨常用铁系催化剂,生产中铁系催化剂起到的作用是
A.加快反应速率 B.使反应物转化更完全
C.降低生产能耗 D.使反应放出更多的能量
 20工业制硝酸的主要反应是:4NH3(g) + 5O2(g)
20工业制硝酸的主要反应是:4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g)+
1025kJ。若反应物起始的物质的量相同,下列关系图错误的是
4NO(g) + 6H2O(g)+
1025kJ。若反应物起始的物质的量相同,下列关系图错误的是
A B C D
18.右图是乙醇氧化制乙醛的实验装置(夹持仪器和加热仪器均未画出;),以下叙述正确的是
A. C处的具支试管可换成普通试管
B. A中所盛的固体可以是CuO
C. D中的乙醇可用沸水浴加热
D.该装置还可用来测定铜的相对原子质量(D中盛浓氨水)
17.已知25℃时,AgI饱和溶液中c (Ag+)为1.22×10-8mol/L,AgCl的饱和溶液中c (Ag+)为1.25×10-5mol/L。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
A.c (K+)>c (NO3-)>c (Ag+) = c (Cl-) + c (I-)
B.c (K+)>c (NO3-)>c (Ag+) >c (Cl-)>c (I-)
C.c (NO3-)>c (K+)>c (Ag+) >c (Cl-)>c (I-)
D.c (K+)>c (NO3-) >c (Cl-) >c (Ag+)>c (I-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com