
题目列表(包括答案和解析)
16. vmL密度为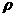 g/mL的某溶液中,含有相对分子质量为M的溶质mg,该溶液中溶质的质量分数为W%,物质的量浓度为c mol/L,那么下列关系式正确的是
g/mL的某溶液中,含有相对分子质量为M的溶质mg,该溶液中溶质的质量分数为W%,物质的量浓度为c mol/L,那么下列关系式正确的是
A.c = B.c =
B.c =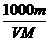 C.W%=
C.W%= %
D.m=
%
D.m=
15.实验室制备乙酸丁酯的环境温度(反应温度)是115-125 oC,其它有关数据如下表:
|
物质 |
乙酸 |
1-丁醇 |
乙酸丁酯 |
98%浓硫酸 |
|
沸点 |
117.9 oC |
117.2 oC |
126.3 oC |
338.0oC |
|
溶解性 |
溶于水和有机溶剂 |
溶于水和有机溶剂 |
微溶于水,溶于有机溶剂 |
与水混溶 |
则以下关于实验室制备乙酸丁酯的叙述错误的是
A.不另用收集装置是因为乙酸丁酯沸点高于反应温度,
B.不用水浴加热是因为乙酸丁酯的沸点高于100oC
C.可用分液的方法从反应后混合物分离出粗产品
D.由粗品制精品需要进行的一步操作:加吸水剂蒸馏
14. 某氖原子的质量是a g,12C原子的质量是bg用NA表示阿伏加德罗常数,则以下叙述中错误的是
A.该氖原子的相对原子质量为12a/b B.Wg该氖原子的物质的量为W/aNA mol
C.Wg 该氖原子所含的质子数为 10W/a个 D 氖元素的摩尔质量为aNA g/mol
13.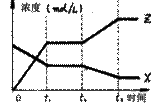 现有反应:X(g) + Y(g)
现有反应:X(g) + Y(g)  2Z(g)
+ Q (Q>0),右图表示
2Z(g)
+ Q (Q>0),右图表示
该反应在t1时达到平衡,在t2时因改变某种条件而发生变化的曲线,t2改变的条件可能是
①增加Y的浓度 ②增加Z的浓度 ③ 降温 ④增压
A.①或③ B. ② C.只有③ D.①或④
12.根据有关化学原理,下列判断正确的是
A.35℃时,某溶液中水的电离度为1.8×10-7,则该溶液是酸或碱溶液
B.若A盐溶于水时溶液温度降低,则A盐一定发生了水解反应
C.常压下,SiCl4沸点为57.6℃,则常压下CCl4沸点低于57.6℃
D.250C时,与足量同体积同浓度的稀硫酸反应,锌粒的速率一定比铁屑快
10. 已知25℃时,电离常数K1(H 2CO3) >K(苯酚) > K2(H 2CO3),且知苯甲酸酸性比碳酸强,

水杨酸( )若与碳酸钠溶液反应有CO2生成,不能同时生成的物质是
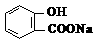
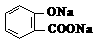
A. B.NaHCO3 C. D.H2O
11某种药物(L–多巴胺)结构如右图所示,关于该化合物的说法错误的是
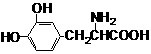 A.可以和浓溴水发生取代反应
A.可以和浓溴水发生取代反应
B.分子式是C9H10O4N
C.既具有酸性,也具有碱性
D.1mol该化合物最多可以和含3molNaOH的溶液发生反应
9. NA代表阿伏加德罗常数,下列说法错误的是
A.标准状况下,2.24 L Cl2与足量的Mg充分反应,转移的电子数目为0.2NA
B.7 g分子式为CnH2n的物质中含有的氢原子数目为NA
C. 标准状况下,22.4 L 氯仿(CHCl3)中含有的氯原子数目为3NA
D.1 L 0.5mol/LNa2CO3溶液中含有的CO32-数目小于0.5NA
8.以下熔点比较错误的是
A.离子晶体: Al2O3>NaF>NaCl B分子晶体CF4>CCl4>CI4
C.原子晶体:金刚石>SiC>Si D. .金属晶体: Na>K>钠钾合金
7. 实验室中,下列除去括号内杂质的有关操作正确的是
A.苯(硝基苯):加少量水振荡,待分层后分液
B.乙醇(水):加新制生石灰,蒸馏
C.CO2(HCl、水蒸气):通过盛有碱石灰的干燥管
D.乙烷(乙烯):催化加氢
6. .以下性质比较的依据正确的是
A.仅用键长数据比较共价键的强度
B.仅用相对分子质量数据比较分子间作用力的大小
C.仅用相同温度下电离常数比较弱酸的相对强弱
D.仅用电子层数的多少比较短周期主族元素原子半径的大小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com