
题目列表(包括答案和解析)
3.向50 mL 18 mol/L硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量(n)为
A.n=0.9 mol B.0.45 mol<n<0.9 mol
C.n=0.45 mol D.n<0.45 mol
2.已知98%的浓H2SO4的浓度为18.4 mol/L,则49%的硫酸溶液的浓度为
A.9.2 mol/L B.大于9.2 mol/L
C.小于9.2 mol/L D.不能确定
1.下列四种溶液中,一定存在SO 的是
的是
A.向甲溶液中加入BaCl2溶液,产生白色沉淀
B.向乙溶液中加入BaCl2溶液,有白色沉淀,再加入盐酸沉淀不溶解
C.向丙溶液中加入盐酸使之酸化,再加入BaCl2溶液,有白色沉淀产生
D.向丁溶液中加入硝酸酸化,再加入硝酸钡溶液,有白色沉淀产生
15.(8分)不同的卤素原子之间可化合形成一系列化合物,这类化合物叫卤素互化物。现将4.66 g BrClx溶于水后,通入足量SO2气体与其反应生成氢溴酸、盐酸和硫酸。再用碱将溶液调至中性后加入过量Ba(NO3)2溶液,充分反应后滤去沉淀物,再向滤液中加过量的AgNO3溶液,最后得15.46 g卤化银沉淀。
(1)完成SO2与BrClx溶液发生反应的化学方程式。
(2)计算确定BrClx中x的值。
14.(10分)某烧瓶中盛有50 mL浓度为12 mol·L-1的浓盐酸,向此烧瓶中加入a g
(a<13)MnO2共热,反应停止后,将烧瓶内的液体冷却并蒸干,结果得到b g固体,试求b g固体中氯元素的质量可能是多少?
13.(6分)将氯气通入溴化钠溶液,充分反应后,用苯进行溴的萃取与分液操作。操作步骤有:①把分液漏斗放在铁架台上,静置片刻;②右手压住漏斗口的塞子,左手握活塞部分,将漏斗倒转过来,用力振荡;③打开漏斗下端活塞待下层液体流出后再关上;④向装有氯气和溴化钠反应产物的分液漏斗中加入适量的苯;⑤让分液漏斗的下端紧靠烧杯内壁;⑥从分液漏斗上口倾倒出液体;⑦把分液漏斗上口的活塞打开。
(1)上面操作步骤的正确排列顺序是 。
(2)操作⑦的目的是 。
(3)可以得到溴的苯溶液的一步操作序号是 。
12.(11分)(1)1986年,化学上第一次用非电解法制得氟气,试配平该反应的化学方程式:
K2MnF6+ SbF5 KSbF6+ MnF3+ F2
KSbF6+ MnF3+ F2
反应中 元素被还原。
(2)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素如
[(CN)2+H2O===HCN+HCNO]。它们阴离子的还原性强弱为Cl-<Br-<CN-<SCN-<I-。
试写出:①(SCN)2与KOH溶液反应的化学方程式
②NaBr和KSCN混合溶液中加入(CN)2反应的离子方程式
11.(11分)在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘,试回答:

(1)乙、丁中溶质的分子式:乙 ;丁 。
(2)第④步操作中用稀H2SO4浸洗的目的是
A.除去未反应的NO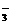 B.除去未反应的I-
B.除去未反应的I-
C.除去未反应的Fe D.除去碱性物质
(3)第⑦步操作可供提纯I2的两种方法是 、 (不要求写具体操作)。
(4)反应⑤中所加硝酸应选浓HNO3还是稀HNO3 ,原因是 。
10.(9分)用滴管将新制的饱和氯水逐滴滴入含酚酞的氢氧化钠的稀溶液(样品)中,当滴到最后一滴时,红色突然褪去,产生该现象的原因可能有两个:
①是由于 (简要文字说明)。
②是由于 (简要文字说明)。
简述怎样用实验证明红色褪去的原因是①或者是②。
9.酸根RO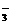 所含电子数比硝酸根NO
所含电子数比硝酸根NO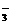 的电子数多10,则下列说法正确的是
的电子数多10,则下列说法正确的是
A.R原子的电子层数比N的电子层数多1
B.RO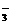 中R的化合价与NO
中R的化合价与NO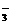 中N的化合价相等
中N的化合价相等
C.RO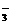 和NO
和NO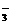 只能被还原,不能被氧化
只能被还原,不能被氧化
D.R与N为同族元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com