
题目列表(包括答案和解析)
10.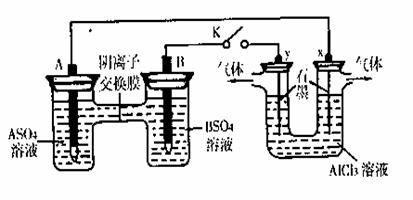 某同学按下图所示的装置进行实验。A、B为两种常见金属,它们的硫酸盐可溶于水。当K闭合时,SO42-从右向左通过交换膜移向A极。下列分析正确的是 ( )
某同学按下图所示的装置进行实验。A、B为两种常见金属,它们的硫酸盐可溶于水。当K闭合时,SO42-从右向左通过交换膜移向A极。下列分析正确的是 ( )
A.溶液中c(A2+)减小B. B的电极反应:B→B2++2e-
C.y电极上有H2产生,发生还原反应 D.反应初期,x电极周围出现白色胶状沉淀
9.下列判断正确的是 ( )
A.在稀氨水中加水稀释, 会增大
会增大
B.若酸性HA>HB,则等物质的量浓度等体积的NaA和NaB溶液混合有关系:
c(OH-)>c(A-)>c(B-)>c(H+)
C.0.1 mol·L-1的一组溶液pH由大到小排列为:
NaOH>Na2CO3>NaHSO4>(NH4)2SO4
D.分别稀释10mLpH=1的盐酸和醋酸至100mL,后者pH变化大,说明醋酸是弱酸
8.下列关于有机物的说法中,正确的是
A.煤的主要成分是焦炭和无机物杂质
B.乙烯和聚乙烯中都含有不饱和C=C双键
C.利用点燃的方法可以鉴别甲烷和乙烯
D.油脂、葡萄糖、蛋白质都可以发生水解反应
7.下列叙述错误的是
A. 钢铁表面发生吸氧腐蚀时,钢铁表面水膜的pH增大
B. 电解精炼铜时,同一时间内阳极溶解的铜的质量比阴极析出的铜的质量少
C. 在镀件上电镀锌,可以用锌作阳极,也可以用惰性电极材料作阳极
D. 工作时在原电池的负极和电解池的阴极上都是发生失电子过程
6.化学与生产、生活、科技等密切相关。下列说法正确的是
A.煤经气化和液化两个物理变化过程,可变为清洁能源
B.国务院要求坚决控制钢铁、水泥、焦炭等行业产能总量是落实“低碳经济”的具体举措
C.苯酚稀溶液常用于外科消毒,所以自来水也可以用苯酚进行消毒处理
D.“神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃
12.有一种蓝色晶体,它的结构特征是Fe2+和Fe3+分别占据立方体互不相邻的顶点,而CN-离子位于立方体的棱上。
⑴根据晶体结构特点,推出其化学式(用最简单整数表示)__________________________。
⑵此化学式带何种电荷?用什么样的离子(用Mn+表示)与其结合成中性的化学式?写出此电中性的化学式。
⑶指出⑵中添加离子在晶体结构中的什么位置。
2010年高考总复习化学培优补差训练(38)
11.有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2∶1。请回答下列问题:
⑴A单质、B单质、化合物R的熔点大小顺序为下列的
(填序号):
 ①A单质>B单质>R;
②R>A单质>B单质;
①A单质>B单质>R;
②R>A单质>B单质;
③B单质>R >A单质; ④A单质>R>B单质。
⑵在CB3分子中C元素原子的原子轨道发生的是______杂化,
其固体时的晶体类型为 。
⑶写出D原子的核外电子排布式 ,C的氢化物比D的
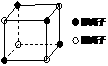
氢化物在水中溶解度大得多的可能原因 。
⑷右图是D和Fe形成的晶体FeD2最小单元“晶胞”,FeD2晶体中阴、阳
离子数之比为 ,FeD2物质中具有的化学键类型为 。
10.有下列8种晶体,用序号回答下列问题:
A.水晶 B.冰醋酸 C.白磷 D.固态氩 E.氯化铵 F.铝 G.金刚石
⑴属于原子晶体的化合物是 ,直接由原子构成的高熔点的单质晶体是 ,直接由原子构成的分子晶体是 。
⑵由极性分子构成的晶体是 ,含有共价键的离子晶体是 ,属于分子晶体的单质是 。
⑶在一定条件下能导电而不发生化学反应的是 ,分子内存在化学键,但受热熔化时,化学键不发生变化的是 ,受热熔化,需克服共价键的是 。
9.石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层碳
原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作
CxK,其平面图形见下图,则x值为 ( )
A.8 B.12 C.24 D.60
8.已知[Co(NH3)6]3+的立体结构如图,其中1~6处的小圆圈
 表示NH3分子,且各相邻的NH3分子间的距离相等(图中虚线
表示NH3分子,且各相邻的NH3分子间的距离相等(图中虚线
长度相等)。Co3+位于八面体的中心,若其中三个NH3被Cl-取代,
所形成的[Co(NH3)3Cl3]的同分异构体的数目为 ( )
 A.1 B.2
C.3
D.4
A.1 B.2
C.3
D.4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com