
题目列表(包括答案和解析)
4. 物质X的结构式如图所示,常被用用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体。下列关于物质X的说法正确的是 ( )
物质X的结构式如图所示,常被用用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体。下列关于物质X的说法正确的是 ( )
A.X分子式C6H7O7
B.1mol物质X可以和3mol氢气发生加成
C.X分子内所有原子均在同一平面内
D.足量的X分别与等物质的量的NaHCO3、Na2CO3 反应得到的气体相同
3.常压下乙醇的沸点是78℃,乙酸的沸点是118℃。下列四种分离乙醇、
乙酸的方案中最佳的一组是 ( )
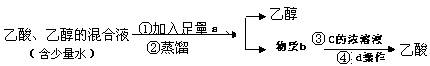
|
|
a |
b |
C |
d |
|
A |
Na2CO3饱和溶液 |
乙酸钠 |
硫酸 |
蒸馏 |
|
B |
Na2CO3 固体 |
乙酸钠 |
盐酸 |
过滤 |
|
C |
CaO固体 |
乙酸钙 |
盐酸 |
过滤 |
|
D |
CaO固体 |
乙酸钙 |
硫酸 |
蒸馏 |
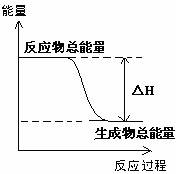
2.下列物质间的反应,其能量变化符合下图的是 ( )
A.由电石制乙炔
B.灼热的碳与二氧化碳反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
D.碳酸钙的分解
1.环保问题是2008年两会上最为热门的话题之一,无论是环境税还是节能减排,每一个有关环保的议案提案都牵动着从各级政府,到企业,再到百姓的条条神经。下列叙述中不正确的是 ( )
A.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
B.倡导人们在购物时使用纸袋或布袋,最好不用塑料袋,是为了防止白色污染
C.在含硫的燃料中加入适量生石灰,以减少二氧化硫的排放量
 D.家中做卫生保洁时,严禁漂白粉与浓盐酸混合使用,否则会产生有毒气体
D.家中做卫生保洁时,严禁漂白粉与浓盐酸混合使用,否则会产生有毒气体
11.(17分)TMB是一种应用指纹检测新型安全的色原试剂。已知TMB中含有碳、氢、氮三种元素,其相对分子质量为240。为测定TMB的组成,用下列各仪器装置,在过量的氧气流中4.80gTMB样品氧化成CO2、H2O和N2,再利用吸收剂分别吸收水和二氧化碳,以确定其中所含碳、氢、氮原子的比例关系。请从下图中选择适当的装置(装置符合气密要求,加热装置等已略去;其他用品可自选)。
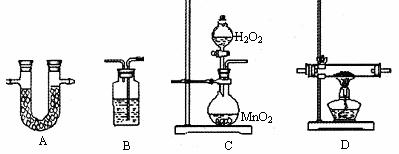
(1)将所选用的仪器(可重复选用)连接顺序由上到下依次填入下表,并写出该仪器中应加的试剂的名称及作用。
|
选用的仪器 |
加入试剂 |
加入试剂的作用 |
|
C |
H2O2溶液与MnO2 |
产生氧气 |
|
|
|
|
|
D |
CuO |
保证C全部转化为CO2 |
|
|
|
|
(2)实验后称得A装置从用的先后顺序排列质量分别增加3.60g、14.08g、0.14g,则TMB的分子式为________________;
10.(12分)注射用双黄连以绿原酸为主要成分(其结构简式如图2)之一,绿原酸有着广泛的药理作用。已知一分子绿原酸在酸性条件下水解得到一分子咖啡酸A(环上有三个取代基,且不完全相邻)和一分子奎尼酸。

某小组研究如下:
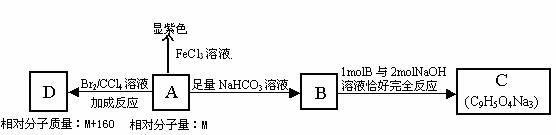
(1)奎尼酸的分子式为_________________________________。
(2)在图2中补充完整绿原酸的结构。
(3)写出咖啡酸与NaHCO3溶液反应的方程式______________ 。
(4)写出符合下列4个条件的A的同分异构体E的结构简式_______________。
①与FeCl3溶液反应显紫色
②1molE分别能消耗2molNa、1molNaOH
③1molE与足量的新制Cu(OH)2反应可得到4molCu2O
④苯环上的一氯代物只有一种
(5)将一定量咖啡酸A与苯甲酸乙酯的混合物点燃。该混合物完全燃烧消耗x L O2,并生成y g H2O和一定量CO2(气体体积均为标准状况下的体积)。列出混合物中咖啡酸A的物质的量计算式______________.
9.(12分)A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
|
阳离子 |
Na+、K+、Cu2+
|
|
阴离子 |
SO42- 、OH- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。
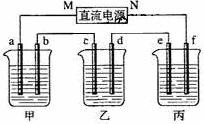
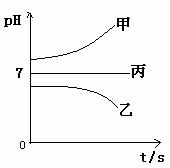
接通电源,经过一段时间后,测得乙中c电极质量增加了16g。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的_____极(填写“正”或“负”)
电极b上发生的电极反应为______________________________;
(2)计算电极e上生成的气体在标准状态下的体积:____________;
(3)写出乙烧杯的电解池反应_____________________________
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
__________________________________________________________。
(5)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,操作是_________________
8.(17分)U、V、W、X、Y为短周期元素,且原子半径依次增大,U、V同主族,V、W、X、Y处于同周期,U的最高价氧化物所对应的水化物与其气态氢化物反应生成盐A,U、W、Y的最高价氧化物对应的水化物能互相反应生成盐,Z为血红蛋白中所必需的金属元素,且U、W、Z分别能与氧元素形成U203、W2O3、Z2O3。
回答下列问题:
(1)U的气态氢化物分子的电子式为____________________,盐A中阳离子的检验方法是_________________________;
(2) 元素V、W、X、Y的第一电离能的大小关系是:______________________,Z原子的最外层电子排布式__________;
(3)W的单质与Y的最高价氧化物对应的水化物的溶液反应,其离子方程式是_________;
(4)z单质与水在一定条件下反应的化学方程式为________________________;
(5)已知:Z(s)+1/2O2(g)=ZO(s) 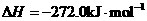
W(s)+3/2O2(g)= W2O3(s) 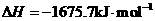
W的单质和ZO反应的热化学方程式是______________________________________。
7.某温度下,在一个2L的密闭容器中,加人4molA和2molB进行如下反应:
3A(g)+2B(g) 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是 ( )
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是 ( )
A.该反应的化学平衡常数表达式是K=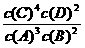
B.此时,B的平衡转化率是35%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加C,B的平衡转化率不变
6.将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.9mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为 ( )
A.0.2mol B.0.4mol C.0.8mol D.0.9mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com