
题目列表(包括答案和解析)
18、(2009年高考福建24)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:

请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为 ;
(2)流程乙加入烧碱后生成SiO32-的离子方程式为 ;
(3)验证滤液B含Fe3+,可取少量滤液并加入 (填试剂名称)。
(4)滤液E、K中溶质的主要成份是 (填化学式),写出该溶液的一种用途 。
(5)已知298K时,Mg(OH)2的容度积常数KSP = 5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的:
c(Mg2+)=

17、(1)硫酸钙微溶于水 (2)除去溶液中Fe3+ ,氨水
(3)取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe3+;
或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+
(4)Ca2+ + CO32- = CaCO3↓ 作化肥(合理即给分)
(5)称量 过量的标准盐酸 (6)0.1%
17、(2009年高考上海27)实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:

(1)溶解大理石时,用硝酸而不同硫酸的原因是 。
(2)操作Ⅱ的目的是 ,溶液A(溶质是共价化合物)是 。
(3)写出检验滤液中是否含铁离子的方法:
。
(4)写出加入碳酸铵所发生反应的离子方程式: ,
写出滤液B的一种用途: 。
(5)CaO2中一般含CaO。试按下列提示完成CaO2含量分析的实验设计。
试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞 仪器:电子天平、锥形瓶、滴定管
实验步骤:
① ;②加入 ;③加入酚酞,用氢氧化钠标准溶液滴定。
(6)若理论上滴定时耗用标准溶液20.00mL恰好完全反应,实际操作中过量半滴(1mL溶液为25滴),则相对误差为 。
16、(1)取少量上层清液,滴加KSCN溶液,,若不出现血红色,则表明Fe(OH)3 沉淀完全。
(2)防止溶液吸收空气中CO2
(3)①酸式滴定管 ②99.9% ③样品中存在少量的NaCl;少量的CaCl2·2H2O失水。
16、 (2009年高考江苏15)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂志)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%-103.0%)的主要流程如下:
(2009年高考江苏15)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂志)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%-103.0%)的主要流程如下:
(1)除杂操作是加入氢氧化钙,调节溶液的PH为8.0-8.5,以出去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的试验操作是
。
(2)酸化操作是加入盐酸,调节溶液的PH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2; ②防止Ca2+在蒸发时水解;③ 。
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.05000mol/L AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
①上述测定过程中需要溶液润洗的仪器有 。
②计算上述样品中CaCl2·2H2O的质量分数为 。
③若用上述办法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有 ; 。
15、(1)适当提高反应温度、增加浸出时间(或其他合理答案)
(2)Fe(OH)3 Al(OH)3 (3)Na2SO4
(4)①在某一温度时,NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化的最大;
NaCl 的溶解度与其他物质的溶解度有一定的差别。
② 降温前,溶液中NaCl已达饱和;降低过程中,NaCl溶解度会降低 ,会少量析出。重结晶。
[考点分析]对常见金属元素及其化合物主要性质的掌握,以及对离子反应实质的认识。考查考生运用基础知识解决简单化学问题的能力,以及对图表观察分析能力。
15、(2009年高考广东22)某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:

|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
PH |
3.2 |
5.2 |
12.4 |
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(要求写出两条)。
(2)滤渣I的主要成分有 。
(3)从滤渣Ⅱ中可回收利用的主要物质有 。
 (4)Mg(ClO3)2在农业上可用作脱叶剂、
(4)Mg(ClO3)2在农业上可用作脱叶剂、
催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3 = Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)
变化曲线如下图所示:
①将反应物按化学反应方程式计量数比混合
制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:
。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 
14、(1)氯化钡溶液或硝酸钡溶液;硝酸银溶液;硝酸溶液
(2)测定溶液的pH(或加入HNO3后不再产生气泡)
(3)除去溶液中过量的Ba2+、Ag+ (4)蒸发、冷却结晶
14、(09杭州儒林﹒育英高复学校第三次)现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、NO3-的相互分离。相应的实验过程可用下列流程图表示:
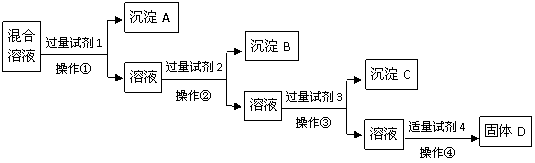

(1)写出上述实验过程中所用试剂的名称:
试剂1 试剂2 试剂4 ;
(2)恰当地控制试剂4的加入量的方法是 ;
(3)加入过量试剂3的目的是 ;
(4)在加入试剂4后,获得固体D的实验操作④是 (填操作名称)。
13、(1)Ba2+ + SO42- = BaSO4↓ Mg2+ + 2OH- = Mg(OH)2↓
Ca2+ + CO32- = CaCO3↓ Ba2+ + CO32- = BaCO3↓
(2)2NaCl + 2H2O
 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
(3)制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等(任写2种)
(4)蒸发浓缩 过滤
蒸发过程中溶剂(水)大量减少,Na+浓度显著增加促进NaCl的沉淀溶解平衡向沉淀方向移动(或:Na+浓度显著增加抑止了NaCl的溶解)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com