
题目列表(包括答案和解析)
2.下列物质,能因强氧化性而使品红溶液褪色的是 ( )
①干燥的C12 ②Na2O2 ③NaClO ④活性炭
⑤HCl0 ⑥SO2
A.除①以外 B.除③以外 C.①②③⑤ D.全部可以
1.洁净煤技术(Clean Coal Technology,简称CCT)的含义是:旨在减少污染和提高效率的煤炭加工、燃烧、转化和污染控制等新技术的总称。下列措施不属于洁净煤技术的是 ( )
A.溶剂萃取脱硫法
B.煤的气化(产物主要为CO和H2)
C.借助高温和催化剂的作用,使煤在氢压下裂解成小分子的烃类液体燃料
D.煤的直接燃烧
12.(15分)已知芳香族化合物C的分子式为C9H9OCl。C分子中有一个甲基且苯环上只有一个侧链,一定条件下C能发生银镜反应;C与其它物质之间的转化关系如下图所示:
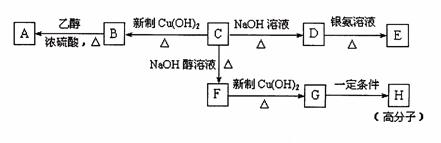
回答下列问题:
(1)C→F的反应类型为 ,B→A反应的反应类型为
(2)高分子H的结构简式为 。
(3)有的同学认为B中可能没氯原子,你是 (填写“同意”或 “不同意”),
理由 。
(4)D→E反应的化学方程式为 。
(5)D的一种同系物W(分子式为C8H8O2)的同分异构体很多,试写出符合以下条件的W的同分异构体有 种 写出其中的三种同分异构体的结构简式: 、 、
①属于芳香族化合物 ②遇FeCl3溶液不变紫色 ③能与NaOH溶液发生反应但不属于水解反应
11.(15分)甲、乙两位同学各称取质量为m的碳酸钠和过氧化钠的混合物样品,并用下图所示仪器测定样品的组分。
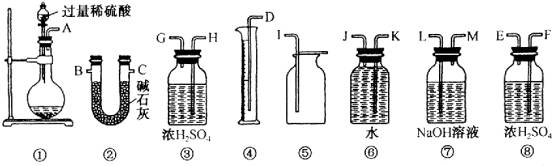
请回答下列问题:
(1)甲同学想通过实验测得的数据是氧气的体积,则仪器的连接顺序为 (按实验先后流程用①②等表示)。
甲同学读取实验数据时的两个注意事项,分别是冷却至室温、 和眼睛视线与凹液面最低处相切。
(2)乙同学想通过仪器的连接顺序①②实验测得的数据是 。按他测得的数据计算出的实验结果偏高,理由是 。
(3)为了测得准确的实验数据,请你将乙同学的实验装置进行改进(每种仪器只准使用一次),写出各仪器接口的连接顺序 。
(4)按(3)设计的实验装置进行实验,若测得实验前后装置②的质量分别是w1和w2,则样品中碳酸钠的质量分数为 。
(5)在(3)的改进装置由于受到仪器的局限,是否有不足 (填“有”或“没有”)若有,请你说出不足的理由 (若没有,此空不必回答).
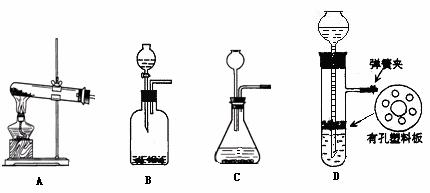
10. (14分)A、B、C、D、E、G、H、I、J是前20号元素组成中学化学常见的化合物, F、H常温下呈气态,B常温下呈液态,其中F是人类生存不能离开的气态单质,反应③常用于焊接和切割金属,其转化关系如下图,据此回答下列问题:
(14分)A、B、C、D、E、G、H、I、J是前20号元素组成中学化学常见的化合物, F、H常温下呈气态,B常温下呈液态,其中F是人类生存不能离开的气态单质,反应③常用于焊接和切割金属,其转化关系如下图,据此回答下列问题:
(1)C为四原子的化合物,请写出C的电子式
(2)写出反应①的化学反应方程式
(3)列出两种E的工业用途 和 (用化学方程式表示)
(4)写出过量的H与D溶液反应的离子反应方程式
(5)实验室中选择合适的试剂,可以用下列一套装置中来制取E、F、H三种气体是 ( )
9.(15分)A、B、C、D、E为原子序数依次增大的五种短周期元素。E元素最高正价与最低负价的代数和为6,C单质既可与盐酸反应又可与NaOH溶液反应,C、E属同一周期,且能形成1:3型化合物;B原子的最外层电子数比次外层电子数多3;A、D原子序数相差8;若用A、B、D三种元素最高价氧化物分别与足量NaOH溶液反应,在得到的溶液中加入过量稀盐酸,只有一种溶液中能析出白色沉淀Y。
(1)写出E元素和钾元素形成的化合物的化学式 。
(2)C的氧化物与氢氧化钠溶液反应的离子方程式为 。
(3)将红热的A单质投入到B的最高价氧化物对应水化物浓溶液中发生反应的化学方程式为 。
(4)生成白色沉淀Y的离子方程式为 。
(5)在1molD的最高价氧化物形成的晶体中,含有共价键 mol
8.在密闭的容器中充入CO2 、HCHO、CH4的混合气体共mg,如果加入足量的Na2O2,充分震荡并不断用点火花引燃至反应完全,测得固体的质量增加mg,则混合气体的平均摩尔质量为 ( )
A.28g·mol-1 B.30g·mol-1 C.38g·mol-1 D.42g·mol-1
7.在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:
 H2(g) + I2(g)
H2(g) + I2(g)  2HI(g) ; △H<0,反应中各物质的浓度随时间变化情况如图1:
2HI(g) ; △H<0,反应中各物质的浓度随时间变化情况如图1:
则下列叙述不正确的是 ( )
A.反应达到平衡时,混合物的平均分子量为110
B.根据图1数据,反应开始至达到平衡时,平均速率v(HI)为0.073mol/(L•min)
C.反应达到平衡后,第8分钟时,若升高温度,HI浓度的变化是图2中c
D.反应达到平衡后,第8分钟时,若加入I2,H2浓度的变化是图2中f
6.常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是 ( )
A.c(HA)<c(A-) B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-) D.c(OH-)=c(H+)+1/2 [c(HA)-c(A-)]
5.下列表示变化的用语中正确的一项是 ( )
A.NaHCO3的水解:HCO3-+H2O H3O++CO32-
H3O++CO32-
B.1 L 0.5mol·L-1稀硫酸与1L lmol· L-1氢氧化钠溶液反应放出57.3kJ 热量:
H2SO4(aq ) +2NaOH ( aq ) = Na2SO 4(aq ) + 2H2O ( l ) ;△H=-57.3kJ · mol -1
C.氢氧燃料电池的负极反应式为:O2 + 2H2O+ 2e一=4OH-
D.以惰性电极电解KCl 溶液:2Cl一十2H2O H2↑
+ Cl2↑+2OH-
H2↑
+ Cl2↑+2OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com