
题目列表(包括答案和解析)
5.[福建师大附中2008-2009学年第一学期期中考试卷高三]下列装置或操作能达到实验目的的是:
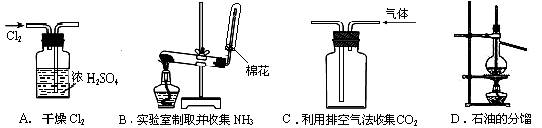
4.[福建漳州双语实验学校09年高考理科综合模拟试卷三化学部分].下列实验操作都能够达到预期目的的是
①.滴加银氨溶液并加热检验甲酸中有无甲醛
②.可以采用多次盐析或多次渗析的方法分离、提纯蛋白质
③.通入澄清石灰水检验SO2 气体中混有CO2
④.滴入酚酞溶液确定纯碱中有无烧碱
⑤.用米汤直接检验食用盐中是否含有碘元素
⑥.往溶液中加入氢氧化钠溶液并加热,生成使湿润红色石蕊试纸变蓝的有刺激性气味气体,证明原溶液含有铵盐
A.①④⑥ B. ②⑤⑥ C. ②⑥ D. ④⑤⑥
3.[福州八中2008-2009高三毕业班第三次质量检查]如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )

①CO、O2; ②Cl2、CH4; ③NO2、O2; ④N2、H2;
(A)①② (B)②④ (C)③④ (D)②③
2. (2009江苏卷6).下列有关实验操作的叙述正确的是:
(2009江苏卷6).下列有关实验操作的叙述正确的是:
A.实验室常用右图所示的装置制取少量的乙酸乙酯
B.用50mL酸式滴定管可准确量取25.00mLKMnO4 溶液
C.用量筒量取5.00mL1.00mol·L-1 盐酸于50mL容量瓶中,
加水稀释至刻度,可配制0.100mol·L-1 盐酸
D.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
1.[福州三中2008-2009学年第一学期高三化学半期考]检验下列物质X是否已部分被氧化变质, 所选用的试剂Y正确的是
|
选项 |
A |
B |
C |
D |
|
X |
Na2SO3溶液 |
FeCl2溶液 |
NaBr溶液 |
H2S溶液 |
|
Y |
BaCl2溶液 |
KSCN溶液 |
淀粉试液 |
NaOH溶液 |
13.二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g) 2SO3(g)。某温度下,SO2的平衡转化率()与体系总压强(p)的关系如图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率()与体系总压强(p)的关系如图所示。根据图示回答下列问题:
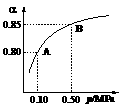
①将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于____________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g);DH =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g);DH =-1160 kJ/mol
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为________(阿伏加德罗常数的值用NA表示),放出的热量为_________kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M = Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
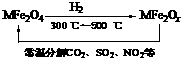
请写出MFe2Ox分解SO2的化学方程式__________________________________(不必配平)。
12.在一定温度下,向一个容积不变的容器中,加入3molSO2和2molO2
及固体催化剂,使之反应。2SO2(g)
+ O2 (g) 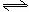 2SO3 (g)
;△H=-196.6kJ/mol。平衡时容器内气体压强为起始时的90%。此时
2SO3 (g)
;△H=-196.6kJ/mol。平衡时容器内气体压强为起始时的90%。此时
Ⅰ、加入3molSO2和2molO2 发生反应,达到平衡时,放出的热量为 。
Ⅱ、保持同一反应温度,在相同的容器中,将起始物质的量改为amolSO2、bmolO2、cmolSO3(g),欲使平衡时SO3的体积分数为2/9 ,
①达到平衡时,Ⅰ与Ⅱ放出的热量 (填序号)。
A、一定相等 B、前者一定小 C、前者大于或等于后者
②a、b、c必须满足的关系是(一个用a、c表示,另一个用b、c表示) 。
③欲使起始时反应表现为向正反应方向进行,a的取值范围是: 。
11.将1molCO和1molH2O(g)充入某固定容积的反应器中,在某条件下达到平衡:
CO+H2O(g)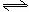 CO2+H2,此时有2/3的CO转化为CO2。
CO2+H2,此时有2/3的CO转化为CO2。
⑴该平衡混合物中CO2的体积分数为
⑵若在相同条件下,向容器中充入1molCO2、1molH2和1molH2O,则达到平衡时与⑴中平衡相比较,平衡应向 (填“正反应方向”、“逆反应方向”或“不”)移动,此时平衡混合物中CO2的体积分数可能是下列各值中的 (填编号)
A.22.2% B.27.55% C.33.3% D.36.8%
⑶结合⑵中计算结果分析若平衡向正方向移动时,则下列说法中正确的是 (填序号)
①生成物的产量一定增加;②生成物的体积分数一定增加;③反应物的转化率一定增大;④反应物的浓度一定降低;⑤正反应速率一定大于逆反应速率;⑥一定使用了催化剂
10. 向体积不变的密闭容器中充入2 mol N2和6 mol H2,一定条件下发生反应:N2(气)+ 3 H2(气) 2
NH3(气),平衡时混合气共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
2
NH3(气),平衡时混合气共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
①.若a=0,b=0,则c=
②.若a=0.7,b=2.1,则:
Ⅰ.c= Ⅱ.这时反应向 进行.
Ⅲ.若要维持反应开始向该反应方向进行(a、b的值可以改变),c的范围是 .
③.欲使起始反应维持向与②相反的方向进行,则b的范围是 .
10.将2molSO2和1molO2混合置于容积为2L的密闭容器中,在800 K时,发生如下反应:
 2SO2 + O2 2SO3
2SO2 + O2 2SO3
当反应从开始进行到5min时,反应达到平衡状态,测得混合气体总物质的量为2.1 mol。
请回答下列问题:
(1)在0-5min时间间隔内SO2的反应速率为____ _。
(2)若在5min时降低温度,在某一时刻重新达到平衡状态,则新平衡混合物中气体的总物质的量 ________2.1 mol(填“>”、“<”或“=”),简述你的判断理由:________ _ _。
(3)若相同条件下,向该容器内分别充人xmolSO2、ymolO2和zmolSO3,反应达到平衡时,容器内混合气体总物质的量仍为2.1 mol。则:x、y、z必须满足的关系是________ __ 。 (一个用含x、z的式子表示,一个用含y、z的式子表示)
(4)相同条件下,若在上述容器中,充入0.2 mol SO2、0.4 mol O2和4.0molSO3三种气
体,下列对该反应状态的描述中,正确的是______ __(填字母序号)。
A.处于平衡状态 B.不是平衡状态,反应正向进行
C.不是平衡状态,反应逆向进行
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com