
题目列表(包括答案和解析)
6、下列有关工业生产的叙述正确的是( )
A、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 B、硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 C、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 D、电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 二、双项选择题
5、已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是( )
A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH- = Mg(OH)2↓+ 2CaCO3↓+ 2H2O B.Cu2+ + H2S = CuS↓+ 2H+
C.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑ D.FeS + 2H+ = Fe2+ + H2S↑
4、下列说法中,正确的是( )
A.KW随温度、浓度的改变而改变 B.凡是能自发进行的化学反应,一定是△H<0、△S>0 C.对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变 D.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关
3、下列过程都与热量变化有关,其中表述不正确的是( )
A.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为
CO (g)+ O2(g) === CO2 (g);△H=-283.0 kJ/mol
O2(g) === CO2 (g);△H=-283.0 kJ/mol
B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式为
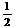 H2SO4(l)+ KOH(l)=
H2SO4(l)+ KOH(l)=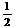 K2SO4(l)+H2O(l);△H= -57.3 kJ/mol
K2SO4(l)+H2O(l);△H= -57.3 kJ/mol
C.铝热反应是放热反应,但需要足够的热量才能使反应发生
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
2、高铁酸钾K2FeO4是一种新型、高效、氧化性比Cl2更强的绿色水处理剂,工业上通常用下列方法先制得高铁酸钠:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,然后在某低温下,在高铁酸钠溶液中加入KOH固体至饱和就可析出高铁酸钾,下列说法不正确的是( )
A.Na2O2在反应中既作氧化剂又作还原剂
B.制取高铁酸钠时,每生成1mol Na2FeO4反应中共有4mol电子转移
C.高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小
D.K2FeO4能消毒杀菌,其还原产物Fe(OH)3胶体能吸附水中的悬浮杂质
1、2009年4月22日是第40个世界地球日,今年世界地球日的主题是“绿色世纪”。下列行为不符合这一主题的是( )
A.分类回收、利用垃圾,减少资源浪费 B.推广使用一次性木筷,减少疾病传染
C.开发风能等洁净能源,减少使用化石燃料 D.研究煤和石油脱硫新技术,减少酸雨发生
8、下列关于化学基本原理和基本概念的几点认识中正确的是( )
A.明矾和漂白粉常用于自来水的净化或杀菌消毒,但两者的作用原理不相同 B.由SO2通入Ba(NO3)2溶液产生白色沉淀可知,BaSO3不溶于硝酸 C.由NaHCO3溶液与NaAlO2溶液混合产生白色沉淀可知,酸性:HCO3->HAlO2 D.胶体区别于其他分散系的本质特征是丁达尔现象
7、165℃、1×105Pa下,两气态有机物以任意比例混合,1L该混合物与9LO2混合,充分燃烧后所得气体体积仍为10L,下列各组混合烃中不符合此条件的是( )
A.CH4、C2H4 B.CH4、C3H6 C.CH3OH、C3H4 D.CH4、C3H4
6、某化学兴趣小组设计了下列四个实验装置,试图通过观察实验现象说明CO2与NaOH溶液发生了反应。其中无法达到实验目的的是( )
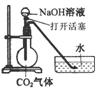
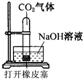
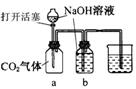
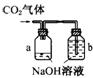
A B C D
5、观察右边几个装置示意图,有关叙述正确的是( )
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源正极相连
C.装置③闭合电键后,外电路电子由a极流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com