
题目列表(包括答案和解析)
3、(15分)化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为
。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为 。
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。①Z与H2O2反应,其产物之一是Y的单质,Y的单质地电子式为 ;Z分子的结构呈 。②A的化学式是 。
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭河导弹上有重要应用),其反应的化学方程式是 。
2、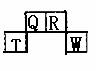 (15分)
(15分) 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为 。
(2)元素的非金属性为(原子的得电子能力):Q W(填“强于”
或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
(原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是 。
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量akJ和bkJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的 =
(注:题中所设单质均为最稳定单质)。
=
(注:题中所设单质均为最稳定单质)。
1.(14分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
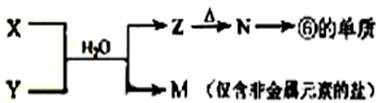
X溶液与Y溶液反应的离子方程式为_____________________,
N→⑥的单质的化学方程式为________________。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
2、配平方法:一标二列三求四配五观六查
具体地说,就是标出反应前后元素的化合价、列出化合价的升降情况、求化合价升降的最小公倍数、根据所求的最小公倍数配出化合价发生变化的物质的系数、用观察法配出所含元素化合价未发生变化的物质的系数、用质量守恒和电荷守恒检查所配结果是否正确。
例: KMnO4+ HCl= KCl+ MnCl2+ Cl2↑+ H2O
系数为:2、16、2、2、、5、8
1、依据原则:在氧化还原反应中,元素得电子的总数=元素失去电子的总数
或化合价升高的总数=化合价降低的总数
2、单线桥分析法
要点:①单线桥是从还原剂中失去电子的元素指向氧化剂中得到电子的元素;
②线上标明只标明电子的数目,不必写其它内容。
1、双线桥分析法
要点:①双线桥从左指向右连接不同价态的同种元素;
②线上标明电子得失、化合价升降、被氧化、被还原等内容(注意得失电子守恒)。
在中学化学中,常用作氧化剂的物质有: 、 、 、 、 、
等;常用作还原剂的物质有活泼的金属单质如 、 、 ,以及 、
、 等。(见人教版必修1第36页)
(1)根据元素的化合价
[练 习]下列微粒:H+、Cu2+、Ag+、Fe2+、Fe3+、 、S2-、
、S2-、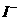 、
、 、
、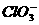 、
、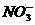 、
、 、S、Cl2、Na、H2;其中只有氧化性的是
;只有还原性的
、S、Cl2、Na、H2;其中只有氧化性的是
;只有还原性的
是 ,既有氧化性又有还原性的是 ;
[思考]如果物质中某元素具有最高价,该元素只有 性;物质中元素具有最低价,该元素只有 性;物质中元素具有中间价态,该元素既有 又有 性。对于同一种元素,价态越高,则 性越强,价态越低,则 性越强。
(2)根据氧化还原反应方程式
强还原剂(A)+强氧化剂(B)=弱氧化产物(a)+弱还原产物(b)
则氧化性:B>a,还原性:A>b
氧化剂的氧化性越强,则其对应的 产物的还原性则越 ;还原剂的还原性越强,则其对应的 产物的氧化性则越 。
(3)根据金属活动性顺序表
在金属活动性顺序表中,位置越靠前,其还原性就越 ,其阳离子的氧化性就越 。
(4)根据元素周期表
同周期元素,随着核电荷数的递增,氧化性逐渐 ,还原性逐渐 ;同主族元素,随着核电荷数的递增,氧化性逐渐 ,还原性逐渐 。
(5)根据反应的难易程度
氧化还原反应越容易进行(表现为反应所需条件越低),则氧化剂的氧化性和还原剂的还原性就越 。
不同的还原剂(或氧化剂)与同一氧化剂(或还原剂)反应时,条件越易或者氧化剂(或还原剂)被还原(或被氧化)的程度越大,则还原剂(或氧化剂)的还原性(或氧化性)就越 ;
(6)其它条件
一般溶液的酸性越强或温度越高,则氧化剂的氧化性和还原剂的还原性就越 ,反之则越弱。
注意:
1物质的氧化性或还原性的强弱只决定于得到或失去电子的 ,与得失电子的 无关。如:Na、Mg、Al的还原性强弱依次为Na>Mg>Al;浓HNO3、稀HNO3的氧化性强弱依次为:浓HNO3 >稀HNO3;
2同一元素相邻价态间不发生氧化还原反应。
|
概 念 |
得失氧的角度 |
化合价变化的角度 |
电子转移的角度 |
|
氧 化 剂 |
在反应中失去氧的物质 |
所含元素化合价降低的物质 |
在反应过程中得到电子的物质 |
|
还 原 剂 |
|
|
|
|
氧化反应 |
物质得到氧的反应 |
物质所含元素化合价升高的反应 |
物质失去电子的反应 |
|
还原反应 |
|
|
|
|
氧化产物 |
---- |
还原剂中所含元素化合价升高以后的对应产物 |
还原剂中失去电子以后的对应产物 |
|
还原产物 |
---- |
|
|
|
氧 化 性 |
---- |
---- |
氧化剂所具有的得到电子的能力 |
|
还 原 性 |
---- |
---- |
还原剂所具有的失去电子的能力 |
判断氧化反应、还原反应及氧化剂和还原剂、氧化产物和还原产物时可抓住下表中的关系:
|
反应物 |
变化特点 |
生成物 |
|
还原剂 |
失、高、氧---氧化反应 |
氧化产物 |
|
氧化剂 |
得、低、还---还原反应 |
还原产物 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com