
题目列表(包括答案和解析)
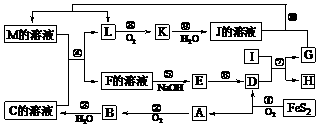
4.(15分)下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第______周期第______族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为________。
(3)在反应②③、⑥、⑨中,既属于化合反应又能属于非氧化还原反应的是_____(填写序号)。
(4)反应④的离子方程式是:_________________________________________。
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:__________________________________。
2.(10分)右图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)
 请按要求回答:
请按要求回答:
(1)写出B的化学式_____________________,
G的电子式______________________。
(2)反应①的离子方程式为_________________________________。
(3)反应②进行的条件是______________、____________。
(4)反应③的化学方程式为____________________________________。
3(14分)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:

请回答:
(1)写出A、B和C的化学式:A ,B ,C 。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
, 。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:
(4)写出由F→H的化学方程式: 。
8.(1)NaOH(1分)
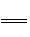 (2)①2Na2O2+2CO2 2Na2CO3+O2(2分) ②2Mg+CO2
(2)①2Na2O2+2CO2 2Na2CO3+O2(2分) ②2Mg+CO2 2MgO+C (2分)
2MgO+C (2分)
③3MgCO3·Mg(OH)2或Mg4(OH)2(CO3)3等;(2分)
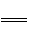 3MgCO3·Mg(OH)2+8HCl 4MgCl2+3CO2↑+4H2O(2分)
3MgCO3·Mg(OH)2+8HCl 4MgCl2+3CO2↑+4H2O(2分)
7.(1)
(2)将D溶液在HCl气流中蒸干;
(3) 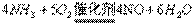
(4) 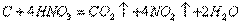
(5) 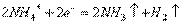
6.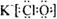 (1) ;第三周期ⅦA族(1分);
(1) ;第三周期ⅦA族(1分);
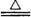 (2)3Cu+8HNO3(稀) Cu(NO3)2+2NO↑4H2O (2分)
(2)3Cu+8HNO3(稀) Cu(NO3)2+2NO↑4H2O (2分)
(3)C2H5OH-12e-+16OH-==2CO32-+11H2O (2分)
 (4)酸性(1分);因为Cu2++2H2O C
Cu(OH)2+2H+,所以溶液中c(OH-)<c(H+)(2分)
(4)酸性(1分);因为Cu2++2H2O C
Cu(OH)2+2H+,所以溶液中c(OH-)<c(H+)(2分)
(5)CuO(或氧化铜)(1分);1.60g;(或CuCO3;2.48g)(2分)
8.已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的
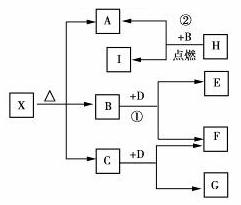 碱性物质,它们有右图所示的关系。 试回答
碱性物质,它们有右图所示的关系。 试回答
下列问题:
(1)G的化学式为:_______________。
(2)写出下列反应的化学方程式
①__________________________________
②_________________________________。
(2) X在医药上用作解酸剂,与盐酸作用时,
生成B的物质的量与消耗盐酸的物质的量之比
为3∶8,则X的化学式为:_____________;
X与盐酸反应的化学方程式为:
_
无机推断题(二)
2(1) (2)弱于
(2)弱于
(3)S+2H2SO4(浓) 3SO2↑+2H2O
3SO2↑+2H2O
(4)2H2O2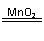
 2H2O+O2↑(或其他合理答案:)
2H2O+O2↑(或其他合理答案:)
(5)NaNO2
(6)(3a – 4b)kJ/mol
3(1)
(2)Al3++4OH-=AlO2-+2H2O
(3)①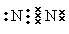 三角锥形 ②AlN
三角锥形 ②AlN
(4)4Al+3TiO2+3C 2Al2O3+3TiC
2Al2O3+3TiC
4(15分)(1)三(1分)II A (1分)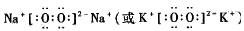 (2分)
(2分)
(2)水分子之间存在氢键且比硒化氢的分子间作用力强(2分)(3)4NH3+3O2 2N2+6H2O(3分)(4)Mg3N2+8HNO3=Mg(NO3)2+2NH4NO3(3分)(5)2(3分)
2N2+6H2O(3分)(4)Mg3N2+8HNO3=Mg(NO3)2+2NH4NO3(3分)(5)2(3分)
5[14分]
(1)CuCO3或Cu2(OH)2CO3或Cu(OH)2·CuCO3;
(2)C>O
(3)CH2OH(CHOH)4CHO+2Cu(OH)2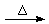 CH2OH(CHOH)4COOH+Cu2O↓+2H2O
CH2OH(CHOH)4COOH+Cu2O↓+2H2O
医学检验糖尿病;
(4)3Cu2O+14HNO3 6Cu(NO3)2+2NO↑+7H2O
6Cu(NO3)2+2NO↑+7H2O
(5)金刚石、石墨、富勒烯。(或无定型炭、炭纳米管等)
7.已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)请填写下列空白:
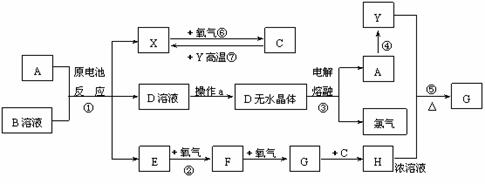
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
(5)原电池反应①中正极的电极反应式为 。
6.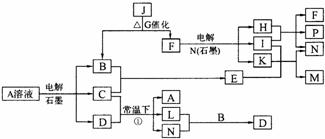 (12分)已知A为蓝色溶液,B、C、I、K为单质,其余均为化合物,其中B、L、I、K 常温下为气体,且I为有色气体。G为黑色固体,F的焰色反应透过蓝色钻玻璃片显紫色,各物质转化关系如图。
(12分)已知A为蓝色溶液,B、C、I、K为单质,其余均为化合物,其中B、L、I、K 常温下为气体,且I为有色气体。G为黑色固体,F的焰色反应透过蓝色钻玻璃片显紫色,各物质转化关系如图。
回答下列问题:
(1) P的电子式是
_____________;
I在元素周期表中的位置是 ________________;
(2)写出反应①的化学方程式: _________________;
(3)已知B、H和C2H5OH能够组成燃料电池,写出该燃料电池的电极反应式:______;
(4)M的水溶液呈___________(填“酸性”“碱性”“中性”),用离子方程式和必要的文字说明原因______________________________________________________________
(5)用惰性电极电解400.00mL A溶液,一段时间内测得溶液pH=1,则需要向溶液中加入___________,其质量为______g,才能使溶液恢复到电解前的状态(不考虑溶液体积变化)。
5.[14分]各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。

请回答下列问题:
(1)写出A的化学式 ,C的电子式 。
(2)比较Y与Z的原子半径大小: > (填写元素符号)。
(3)写出反应②的化学方程式(有机物用结构简式表示) ,
举出该反应的一个应用实例 。
(4)已知F溶于稀硝酸,溶液变成蓝色,放出无色气体。请写出该反应的化学方程式
。
(5)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列
为正四面体,请写出N及其1种同素异形体的名称 、 。
4、(15分)已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2︰3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。

请回答下列问题:
(1)组成B单质的元素位于周期表第 周期,第 族。化合物C的电子式
为 。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是 。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:
。
(4)写出D与足量的N反应生成E和F的化学方程式: 。
(5)上图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有 个。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com