
题目列表(包括答案和解析)
12.(17分)
|
(2)S+2H2SO4(浓)═ 3SO2↑+2H2O(3分)
(3)由于SO2溶解度较大,生成了Ca(HSO3)2溶液的缘故。(3分)取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成。(或者加热、加盐酸检验SO2气体等方法,开放题,正确即可给分。3分)
(4)CuO、CuS、Cu2S(共4分,完全正确给4分,对1~2个给1~2分)
11. (20分)
(20分)
(1)① 如图配置(4分)
② 打开分液漏斗上口的活塞,旋开
分液漏斗的旋塞,缓慢滴加。(2分)
(2)① 溶液褪色(2分)
② 溶液褪色(2分)
③ 有浅黄色沉淀(或溶液变浑浊) (2分)
(3)① NaSO3 变质(2分);取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2 ,溶液有白色沉淀生成,则证明该NaSO3 固体变质(2分)
② 不是浓硫酸(2分);用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸(2分)
10.(16分)
(1)Na2SO3在空气中加热时易被氧气氧化为Na2SO4,2Na2SO3+O2=2Na2SO4(4分)
(2)4Na2SO3=Na2S+3Na2SO4 (4分)
 (3)S2-+H2O HS-+OH-(4分)
(3)S2-+H2O HS-+OH-(4分)
(4)(检验S2-和SO42-的方案都可以)检验SO42-的方案:取适量加热后的固体加入适量的水配成溶液,向溶液中加入氯化钡溶液,如出现白色沉淀,最后向其中加入大量盐酸后白色沉淀不消失,则证明其猜想正确。(4分)(其它正确方案均可)
9.(15分)
(1)X>C>B>D(或写作MnO2>Cl2>H2O2>H2SO4) (3分)
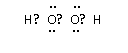 (2)(3分)
(2)(3分)
(3)Cu +2H2SO4(浓)  CuSO4 +SO2 ↑+2H2O (3分)
CuSO4 +SO2 ↑+2H2O (3分)
(4)Cl2 +SO2 +2H2O = 4H+ +SO42-+2Cl- (3分)
MnO2 +4H+ + 2Cl- Mn2+ +Cl2 ↑+2H2O (3分)
Mn2+ +Cl2 ↑+2H2O (3分)
12.(17分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
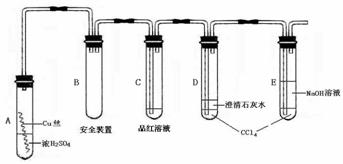
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
以下是该学习小组部分交流记录及后续探究实验的记录
|
|
根据上述材料回答下列问题
(1) A试管上方的长导管的作用是___________________________________________;D、E两支试管中CCl4的作用是__________________________________________。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式: 。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:
______________________________________。设计实验验证你的猜想_________
____________________________________________________________________。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是
_________________________。(写化学式)
2009高三化学专题训练(10)(氧族元素)
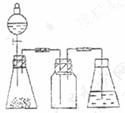
11.(20分)研究性学习小组进行SO2的制备及性质探究实验。
(1)根据反应Na2SO3(固)+H2SO4(浓)= Na2SO4 + SO2↑+ H2O,制备SO2气体。
①用下列简图,在本页顶部画出制备并收集SO2的实验装置(含试剂)示意图。

②实验过程中,使用分液漏斗滴加浓硫酸的操作是________________________
。
(2)将SO2气体分别通入下列溶液中:
①品红溶液,现象是___________________________________________________;
②溴水溶液,现象是___________________________________________________;
③硫化钠溶液,现象是_________________________________________________。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
① 原因_____________________________;验证方法________________________
_________________________________________________________________。
② 原因_____________________________;验证方法________________________
________________________________________________________________。③ 原因_____________________________;验证方法________________________
_________________________________________________________________。
10.(16分)某校化学兴趣小组学生取纯净的Na2SO3·7H2O50.00g,然后隔绝空气在600℃以上的强热至恒重(完全反应),分析及计算表明,恒重后的固体质量相当于无水亚硫酸钠的计算值,而且各元素的组成也与无水亚硫酸钠符合,但将它溶于水,却发现溶液的碱性大大高于期望值。经过仔细思考,这位同学猜想Na2SO3加热后发生了歧化反应从而很好解释这种反常现象,并设计了另一组实验,验证了自己的解释是正确的。
(1)加热Na2SO3·7H2O时为什么要隔绝空气(请用简要文字和化学方程式表示)?
___________________________________________________________________。
(2)他对反应现象的解释是 (用化学方程式表达)
(3)溶液的碱性大大高于期望值的原因是:(用离子方程式表达)
___________________________________________________。
(4)你估计他设计了什么实验来验证他的猜想。(请你写出一种可行的实验方案):
9.(15分)已知A-F是中学化学中常见物质,其中A、C、E为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。
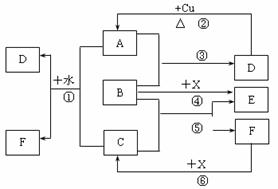
试回答下列问题:
(1)根据图中信息,B、C、D、X氧化性从强到弱的顺序是_______________________。
(2)B的电子式为_________________。
(3)写出反应②的化学方程式:__________________________________________。
(4)写出反应①、⑥的离子方程式:
①___________________________________________________________________。
⑥___________________________________________________________________。
8.一定量的锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6L(标准状况)。将反应后的溶液稀释至1 L,溶液的pH=1,则下列叙述中错误的是
A.气体A为SO2和H2的混合物 B.气体A中SO2与H2的体积之比为4:1
C.反应中共消耗97.5g Zn D.反应中共转移3 mol电子
7.下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
工业生产硫酸用水吸收SO3 |
SO3可与水反应 |
Ⅰ对,Ⅱ对,有 |
|
B |
Cl2与SO2混合后可用于漂白纸张 |
Cl2和SO2有较好的漂白作用 |
Ⅰ对,Ⅱ错,无 |
|
C |
金属钠具有强还原性 |
高压钠灯发出透雾性强的光 |
Ⅰ对,Ⅱ对,无 |
|
D |
石墨常用作电解池的电极 |
石墨的化学性质稳定且导电性好 |
Ⅰ对,Ⅱ对,有 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com