
题目列表(包括答案和解析)
6.(20分)高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。


(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质相同的是
(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是___(填代号)。
a. 浓硝酸 b. 硝酸银 c. 氯水 d. 烧碱
(3)上述流程中可以循环使用的物质有______________、______________(写化学式)。
(4)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得____mol KMnO4。
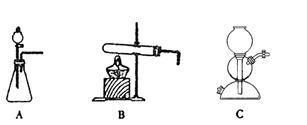
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择___________(选填代号)。
a. 石灰石 b. 稀HCl c. 稀H2SO4 d. 纯碱
所需气体发生装置是_____________(选填代号)。
(6)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在_________________(填性质)上差异,采用_________________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
5.某白色固体可能是由①NH4Cl 、②AlCl3、③NaCl、④AgNO3、⑤KOH中的一种或几种组成。将此固体投入水中,得澄清溶液,该溶液可使酚酞呈红色,向该溶液中加稀硝酸至过量,有白色沉淀产生。以下对原固体的判断中不正确的是
A.肯定存在① B.至少存在①④⑤
C.无法确定是否有③ D.至少存在②和⑤
4.有些单质,易溶于含同一元素的盐溶液中,如:硫易溶于硫化钾溶液中,对于由①CaCO3、②KI、③Al(OH)3、④AgOH(Ag2O)、⑤I2五种物质所组成的混合物,要使其每种成分逐一溶解(一次只溶解一种物质),试剂选用顺序正确的是
A.氨水→乙醇→水→氢氧化钾→硝酸
B.四氯化碳→水→氨水→氢氧化钠→盐酸
C.水→苯→氨水→氢氧化钾→硝酸
D.水→盐酸→氢氧化钠→氨水→乙醇
3.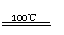
 根据“绿色化学”的思想,某化学家设计了下列化学反应步骤:
根据“绿色化学”的思想,某化学家设计了下列化学反应步骤:
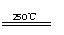
 ①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2↑
①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2↑
③HgBr2+CaO HgO+CaBr2 ④2HgO 2Hg+O2↑
该方案的目的是为了制备
A.HBr B.CaO C.H2 D.Hg
2.要使溶液中的Ag+、Ba2+、Mg2+、Al3+等离子逐一形成沉淀析出,选择的试剂及加入的顺序都正确的是
A.NaCl→Na2SO4→NaOH→HCl
B.HCl→H2SO4→NaOH→CO2
C.H2SO4→HCl→NaOH→CO2
D.Na2SO4→NaCl→NaOH→HCl
1.钛被誉为“未来钢铁”、“太空金属”,原因是它的强度大,密度小,抗腐性能好,室温下,它不与水、稀盐酸、稀H2SO4、稀HNO3作用,但易溶于氢氟酸,推测其原因是
A.氢氟酸的酸性比其它酸强
B.氢氟酸的氧化性比其它酸强
C.氢氟酸的还原性比其它酸强
D.钛离子易与氟离子形成可溶性难电离物质
13.(13分)氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:

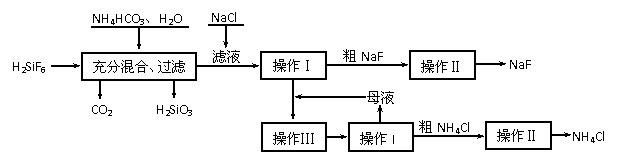
有关物质在水中溶解度分别为:氯化铵:10℃时33.3 g、20℃时37.2 g、30℃时41.4g;氟化钠:20℃时4 g;氟硅酸钠微溶于水。
请回答下列问题:
(1)上述流程中发生两步化学反应,第一步反应的化学方程式为:
,第二步反应能进行是因为
。
(2)操作Ⅰ需要用到的玻璃仪器除玻璃棒外,还有 。
(3)操作II的作用是 。
(4)操作Ⅲ的具体过程是 。
(5)流程中NH4HCO3必须过量,其原因是 。
。
12.(15分)为了预防碘缺乏症,国家规定每千克食盐中应含40-50mg碘酸钾。碘酸钾晶体有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂作用生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等强氧化剂氧化为更高价的碘的含氧酸盐。 工业生产碘酸钾的流程如下:

(1)碘的原子序数为 。
(2)碘、氯酸钾和水混合后的反应为:I2+KClO3+H2 O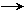 KH(IO3)2+KCl+Cl2↑。已知反应时,两种还原产物所得电子数目相同,请配平该反应的化学方程式:
KH(IO3)2+KCl+Cl2↑。已知反应时,两种还原产物所得电子数目相同,请配平该反应的化学方程式:
。
(3)混合反应后,用稀酸酸化的作用是 ,在稀盐酸和稀硝酸中不能选用的酸是 ,理由是 。
(4)X的化学式为 ,写出用试剂X调节pH的化学方程式
(5)生产中,如果省去“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应后溶液的pH,对生产碘酸钾有什么影响?
。
11.(18分)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)由海带灰获取Iˉ溶液的具体操作是____________________________________
___________________________________________________________。
(3)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(4)步骤④反应的离子方程式是 。
此步操作还可以加入更合适的试剂是_________(从下面选择填代号);理由是___
____________________________________________________________________。
A、浓硫酸 B、新制氯水 C、酸化KMnO4溶液 D、酸化H2O2
(5)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(6)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
。
10.(18分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
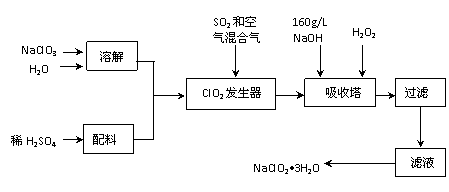

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
(a)将SO2氧化成SO3,增强酸性; (b)稀释ClO2以防止爆炸; (c)将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为 。
吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
(a) Na2O2 (b) Na2S (c)FeCl2 (d)PbO(悬浊液)
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com