
题目列表(包括答案和解析)
1.把3molA和2.5 molB混合盛入容积为2L的容器内,发生反应:
3 A(g) + B(g)  x C(g)+2 D(g)
x C(g)+2 D(g)
5min后达到平衡并生成1molD,测得C的平均生成速率为0.1 mol·L-1·min-1,下列叙述正确的是
A.x的数值为2 B.A的平均消耗速率为0.3 mol.L-1·min-1
C.B的转化率为80﹪ D.B的平衡浓度为2 mol·L-1
13. (14分)Xe和F2在不同温度下反应可得XeF6、XeF4和XeF2三种氟化物,下图表述的是将0.125mol/L
Xe和1.225mol/L F2为起始反应物,在一个体积固定的容器内发生反应,得到的生成物在平衡体系内的物质的量分数与反应温度的关系。
(14分)Xe和F2在不同温度下反应可得XeF6、XeF4和XeF2三种氟化物,下图表述的是将0.125mol/L
Xe和1.225mol/L F2为起始反应物,在一个体积固定的容器内发生反应,得到的生成物在平衡体系内的物质的量分数与反应温度的关系。
(1)420K时,发生反应的化学方程式为:
_________________________________。
(2)制备XeF6和XeF4最适宜的温度分别约为
__________K和__________K。
(3)600-800K时,会发生反应:
XeF6(g) XeF4(g)+ F2(g),其反应热△H _______0(填“>”“=”或“<”)。理由是______________________________________________________________
XeF4(g)+ F2(g),其反应热△H _______0(填“>”“=”或“<”)。理由是______________________________________________________________
。
(4)900K时,容器中存在的组分有_________________________________。
(5)若在某温度下,反应只生成XeF2,其物质的量分数为0.08,求反应混合物中XeF2的浓度。(写出计算过程)
12.(8分)钾是-种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:Na(l)+KCl(l) NaCl(l)+K(g)(ΔH >0),各物质的沸点与压强的关系见下表。
NaCl(l)+K(g)(ΔH >0),各物质的沸点与压强的关系见下表。
|
压强(kPa) |
13.33 |
53.32 |
101.3 |
|
K的沸点(℃) |
590 |
710 |
770 |
|
Na的沸点(℃) |
700 |
830 |
890 |
|
KCl的沸点(℃) |
|
|
1437 |
|
NaCl的沸点(℃) |
|
|
1465 |
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取钾的过程中,为了提高原料的转 化率可以采取的措施是
。
(3)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为:K= 。
11.(12分)如图所示,容器A左侧是可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)  Z(g)+2W(g);∆H<0达到平衡时V(A)=1.2aL。试回答:
Z(g)+2W(g);∆H<0达到平衡时V(A)=1.2aL。试回答:
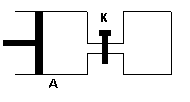 (1)A中X的转化率为
。
(1)A中X的转化率为
。
(2)A、B中X转化率大小关系为A B
(填“>”、“<”、“=” )
(3)打开K,一段时间后又达到新的平衡时,
A的体积为 L(连通管中气体体积不计)
(4)在(3)达到平衡后,同时等幅升高A、B的温度,达到平衡后,A的体积
(填变大、不变、或变小),其理由是
。
10.(12分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g),根据题意完成下列各题:
CH3OH(g),根据题意完成下列各题:

(1)反应达到平衡时,平衡常数表达式K= ,
升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500 ℃,从反应开始到平衡,氢气的平均反应速率
v (H2)= 。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是 。。
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_________________________________(用方程式表示)。
9.(14分)学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
I 课题名称:____________________________________________________________
II实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、____________、____________、____________等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
III 实验步骤:略
IV 实验数据:
|
实验 编号 |
KClO3(g) |
氧化物 |
产生气体(mL) |
耗时(s) |
||
|
化学式 |
质量(g) |
回收 |
(已折算到标况) |
|||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V 实验讨论:
(1) 在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、______、_____。
(2) 实验编号3的实验中KClO3的分解率为_________%(保留一位小数)。
(3) 在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气体是________(填分子式),可用________________试纸检验。上述异常现象产生的原因是______________________________________________。
VI 实验结论:____________________________________________________________。
8. 一定温度下,有可逆反应:2A(g)+2B(g)
一定温度下,有可逆反应:2A(g)+2B(g)  C(g)+3D(g);ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图所示),保持反应过程中两容器的温度与起始时相同。下列说法正确的是
C(g)+3D(g);ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图所示),保持反应过程中两容器的温度与起始时相同。下列说法正确的是
A.甲、乙两容器中的反应达到化学平衡时,两容器内压强相等
B.甲、乙两容器中的反应达到化学平衡时,C的体积分数相等
C.向甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度不变
D.向乙容器中再充入2molC和6molD,平衡后乙中物质C的浓度为原来的2倍
7.在一密闭容器中充入2molA和lmolB发生反应:2A(g)+B(g)  xC(g),达到平衡后,C的体积分数为W%,若维持容器的容积和温度不变,按起始物质的量A
0.6mol、B
0.3mol、C
1.4mol充入容器达到平衡后,C的体积分数仍为W%。则下列叙述中正确的是
xC(g),达到平衡后,C的体积分数为W%,若维持容器的容积和温度不变,按起始物质的量A
0.6mol、B
0.3mol、C
1.4mol充入容器达到平衡后,C的体积分数仍为W%。则下列叙述中正确的是
A.平衡时A 、B的物质的量之比一定为2:1 B.x的值可能是2,也可能是3
C.平衡时A 的物质的量与原平衡一定相等 D.C的体积分数不可能为W%
6.某温度下,在容积固定的密闭容器中可发生可逆反应A(g)+2B(g) 2Q(g),平衡时,各物质的量浓度比为c(A)∶c(B)∶c(Q)=1∶1∶2,保持温度不变,以1∶1∶2的体积比再充入A、B、Q,则下列叙述正确的是
2Q(g),平衡时,各物质的量浓度比为c(A)∶c(B)∶c(Q)=1∶1∶2,保持温度不变,以1∶1∶2的体积比再充入A、B、Q,则下列叙述正确的是
A.刚充入时反应速率v正减少,v逆增大
B.达到新的平衡时,反应混合物中A、B的物质的量分数增加
C.达到新的平衡时,c(A)∶c(B)∶c(Q)仍为1∶1∶2
D.达到新的平衡过程中,体系压强先增大,后逐渐减小
5.根据下列有关图象,说法不正确的是

A.由图象Ⅰ知,该反应在T1、T3处达到平衡,且该反应的△H<0
B.由图象Ⅱ知,该反应在t5阶段NH3体积分数最大
C.图象Ⅲ是在10L容器中850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
D.由图象Ⅳ知,相同条件下起始时投入0.3mol/LX、0.1mol/LY和0.4mol/LZ反应,达到平衡后,Z的浓度为0.4mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com