
题目列表(包括答案和解析)
13.(6分)已知下列两个热化学方程式; H2(g)+1/2 O2(g)===H2O(1); △H=-285.0kJ/mol;
C3H8(g)+5O2(g)===3CO2(g)+4H2O(1); △H=-2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(1)=H2O(g);△H=+44.0kJ/mol。写出丙烷燃烧生成CO2和气态水的热化学方程式:
12.(16分)在两支试管中分别加入3mL 2mol·L-1的稀盐酸,将两个各装有0.3gNaHCO3和0.3g Na2CO3粉末的小气球分别套在试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到的现象如下:
(1)试管中(填产生沉淀或气体及反应速率等相关现象)_________________________
________________________________________________________________________。
(2)盛_____的试管中气球变得更大,大小气球体积之比约为_____(填最简单整数比)。
(3)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有所升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式:
HCO3– (aq)+H+(aq)=H2O(l)+CO2(g);ΔH>0 CO32– (aq)+2H+(aq)=H2O(l)+CO2(g);ΔH<0
甲同学下结论的方法是否正确 (填“正确”或“不正确”)。
(4)为研究上述反应是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
|
序号 |
试剂1 |
试剂2 |
混合前温度 |
混合后最高或最低温度 |
|
① |
35mL水 |
2.5g NaHCO3固体 |
20℃ |
18.5℃ |
|
② |
35mL水 |
3.2 Na2CO3固体 |
20℃ |
24.3℃ |
|
③ |
35mL稀盐酸 |
含2.5g NaHCO3的饱和溶液32.5mL |
20℃ |
19℃ |
|
④ |
35mL稀盐酸 |
含3.2g Na2CO3的饱和溶液23.1mL +10ml水 |
20℃ |
24.2℃ |
|
⑤ |
35mL稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
16.2℃ |
|
⑥ |
35mL稀盐酸 |
3.2g Na2CO3固体 |
20℃ |
25.1℃ |
请你帮助填写相关内容:
该研究报告的题目是《____________________________________________________》;
该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为______________和______________;
通过上述实验可得出五条结论:
a:NaHCO3的溶解是__________(填“吸热”或“放热”,下同)过程;
b:Na2CO3的溶解是__________过程;
c:NaHCO3的饱和溶液和盐酸的反应是__________反应;
d:Na2CO3的饱和溶液和盐酸的反应是__________反应;
e:NaHCO3固体与稀盐酸反应的反应热是由_________(填a~d的字母)的热效应之和。
11.(6分)一些盐的结晶水合物,在温度不太高时就有熔化现象,既溶于自身的结晶水中,又同时吸收热量。它们在塑料袋中经日晒能熔化,在日落后又可缓慢凝结而释放热量,用以调节室温,称为潜热材料。现有几种盐的水合晶体有关数据如下:
|
|
Na2S2O3·5H2O |
CaCl2·6H2O |
Na2SO4·10H2O |
Na2HPO4·12H2O |
|
熔点(℃) |
40.50 |
29.92 |
32.38 |
35.1 |
|
熔化热(kJ/mol) |
49.7 |
37.3 |
77 |
100.1 |
(1)上述潜热材料中最适宜应用的两种盐是 (用化学式表示) 。
(2)实际应用时最常采用的(由来源和成本考虑)应该是 。
10.断裂一个给定的键时所消耗的能量称为离解能,提供下列烷烃的C-H键的离解能:
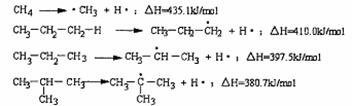
根据提供数据判断下列说法不正确的是
A.离解能愈小,C-H键易断裂,氢原子越易被取代
B.在光照条件下丙烷与氯气发生取代反应CH3CH2CH2Cl与CH3CHClCH3的物质的量之比为1:1
C.异丁烷与氯气发生取代反应,(CH3)3CCl占一氯代物的物质的量分数大于10%
D.C2H6中C-H的离解能介于410.0 kJ /mol~435.1kJ/mol
班别 座号 姓名 评分
选择题答题表
9.已知下列热化学反应方程式:
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H =-24.8kJ/mol
Fe2O3(s)+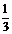 CO(g) =
CO(g) =  Fe3O4(s)+
Fe3O4(s)+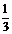 CO2(g)
△H =-15.73kJ/mol
CO2(g)
△H =-15.73kJ/mol
Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) △H =+640.4kJ/mol
则14gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H约为
A.-218kJ/mol B.-109kJ/mol C.+218kJ/mol D.+109kJ/mol
8.右图是198K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
 A.该反应的热化学方程式为:
A.该反应的热化学方程式为:
N2+3H2
 2NH3,△H=–92kJ·mol-1
2NH3,△H=–92kJ·mol-1
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.加入催化剂可增大正反应速率,降低逆反应速率
7.已知乙烯和乙炔燃烧的热化学方程式分别为:
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH= -2600 kJ·mol―1
C2H4(g)+3O2(g)=2CO2(g)+2H2O(l);ΔH= -1411 kJ·mol―1
又知氧炔焰的温度比乙烯燃烧时火焰的温度高。据此,下列说法错误的是
A.物质的燃烧热越大,火焰温度越高
B.烃完全燃烧时,火焰温度的高低不仅仅取决于其燃烧热的高低
C.相同条件下等体积乙烯和乙炔完全燃烧时,乙炔放热较多
D.1mol乙烯完全燃烧生成气态产物时,放出的热量小于1411 kJ
6.将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是
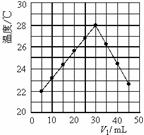 A.做该实验时环境温度为22 ℃
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.50 mol/L
D.该实验表明有水生成的反应都是放热反应
5.灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
已知:①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g);DH1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g);DH2
③Sn(s、灰)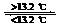 Sn(s、白);DH3=+2.1 kJ/mol
Sn(s、白);DH3=+2.1 kJ/mol
下列说法正确的是
A.DH1<DH2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
4.下列说法中正确的是
A.在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)= C(金刚石);△H= +119kJ·mol-1”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与1mol NaOH溶液混合,放出的热量大于57.31 kJ
D.在101Kpa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H= +285.8kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com