
题目列表(包括答案和解析)
6.下列各项所述的两个量,前者一定大于后者的是 ①纯水在25 ℃和80 ℃的pH ② 1 molNaHSO4和1 mol Na2SO4在熔化状态下的离子数 ③ 25℃时,等体积且pH都等于3的盐酸和A1C13的溶液中,已电离的水分子数
④Na+和 F-的离子半径 ⑤含1molFeCl3的饱和溶液与水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目与阿伏加德罗常数
A.② ④ B.只有① C.①③⑤ D.②⑤
w.w.^w.k.&s.5*
5. 在一接近中性的含Na+的溶液中,可能还存在NH4+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的某几种。进行以下实验:①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;②向呈橙黄色溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉变蓝。由此可以推知该溶液中肯定不存在的离子是( )
A. NH4+、Br-、CO32- B. NH4+、I-、SO32-
C. Fe2+、I-、SO32- D. Fe2+、CO32-、I-
4.实验是化学研究的基础,关于下列各实验装置的叙述中,正确的是
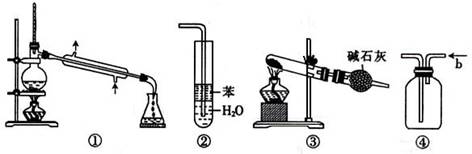
A.装置①常用于分离互不相溶液体混合物
B.装置②可用于吸收HCl气体,并防止倒吸
C.以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D.装置④b口进气可收集CO2、NO等气体
3. 在一密闭容器里进行下列反应A(g)+B(g)
在一密闭容器里进行下列反应A(g)+B(g)  2C+D(g)此反应符合下列两个图象,则此反应符w.w.^w.k.&s.5*
2C+D(g)此反应符合下列两个图象,则此反应符w.w.^w.k.&s.5*
A.正反应为吸热反应,C是固体
B.正反应为吸热反应,C是气体
C.正反应为放热反应,C是气体
D.正反应为放热反应,C是固体或液体
2. F2和Xe在一定条件下可生成氧化性极强且极易水解的XeF2、XeF4和XeF6三种化合物。如XeF4与水可发生如下反应:6XeF4+12H2O==2XeO3+4Xe↑+24HF+3O2↑。下列判断中正确的是
A.XeF2分子中各原子均达到八电子结构
B.上述反应中只有XeO3分子为氧化产物
C.上述反应中氧化剂和还原剂的物质的量之比为1∶2
D.XeF4按已知方式水解,每生成4molXe,转移12mol电子
1. 下列有关叙述中,正确的是
A. 氧元素的相对原子质量为16.00,故氧原子核内的质子数和中子数均是8
B. 等物质的量的CH5+离子和NH4+离子中所含有的质子数相等
C. 白磷分子的摩尔质量为31
D. NaOH中既含有离子键又含有非极性键
18.下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
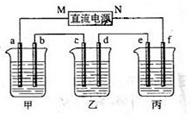 ①电源的N端为______
极;
①电源的N端为______
极;
②电极b上发生的电极反应为___________________;
③列式计算电极b上生成的气体在标准状态下的体积
④电极c的质量变化是____________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ;
乙溶液 ;
丙溶液 。
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
17.某同学设计实验探究构成原电池的条件,装置如下:
 实验一:实验探究电极的构成〈甲图〉
实验一:实验探究电极的构成〈甲图〉
①A、B 两极均选用石墨作电极,发现电流计指针不偏转;② A、B 两极均选用铜片作电极,发现电流计指针不偏转;③ A极用锌片,B极用铜片,发现电流计指针向左偏转;④ A极用锌片,B极用石墨,发现电流计指针向左偏转。
结论一:____________________________________。
实验二:探究溶液的构成〈甲图,A极用锌片,B极用铜片)
①液体采用无水乙醇,发现电流计指针不偏转;
②改用硫酸溶液,发现电流计指针偏转,B极上有气体产生。
结论二 :____________________________________。
实验三:对比实验,探究乙图装置能否构成原电池
将锌、铜两电极分别放入稀硫酸溶液中,发现锌片上有气泡产生,铜片上无明显现象,电流计指针不发生偏转。
结论三:____________________________________。
思考:对该同学的实验,同学乙提出了如下疑问,请你帮助解决。
(1)在甲图装置中,若A 为镁片,B为铝片,电解质溶液为NaOH溶液,电流计的指针应向____偏转。
(2)一根金属丝两端分别放在图乙的两个烧杯之中,电流计指针_______(填“能”或“不能”)偏转。
16. 铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
 Pb+PbO2+4H++2SO42-
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是________________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成________、B电极上生成________,此时铅蓄电池的正极将变为电解池的________极。
15.依据氧化还原反应:2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)设计的原电池如图所示。

请回答下列问题:
(1)电极X的材料是_________;电解质溶液Y是_________;
(2)银电极发生的电极反应为________________________;X电极上发生的电极反应为___________________________;
(3)外电路中的电子是从_________电极流向_________电极。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com