
题目列表(包括答案和解析)
15.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。已知:2Fe2++Br2===2Fe3++2Br- 2Fe3++2I-===2Fe2++I2 则下列有关说法中,不正确的是 ( )
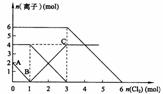 A.还原性:
A.还原性:
B.原混合溶液中FeBr2的物质的量为6mol
C.当通入2molCl2时,溶液中已发生的离子反应可表示为:
2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
D.原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
[2010枣庄一模]
答案:9.B 10.C 11.C 12.D 13.D 14.B 15.A
14.向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
( )
A.0.21mol B.0.25mol C.0.3mol D.0.35mol
13.甲、乙两烧杯中分别盛有10mL 1mol·L-1AlCl3溶液,在甲烧杯中加入一定量NaOH溶液;乙烧杯中加入与上述NaOH溶液等体积、等pH的氨水。下列有关两个烧杯的说法中,正确的是 ( )
A.甲中产生的沉淀一定比乙中多
B.乙中产生的沉淀一定比甲中多
C.甲和乙产生的沉淀一定一样多
D.甲和乙中产生的沉淀可能一样多
12.对下列各溶液中,微粒的物质的量浓度关系表述正确的是 ( )
A.0.1mol·L-1的(NH4)2SO4溶液中:
B.0.1mol·L-1的NaHCO3溶液中:
C.将0.2mol·L-1NaA溶液和0.1mol·L-1盐酸等体积混合所得碱性溶液中:

D.在25°C100mLNH4Cl溶液中: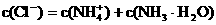
11.下列表示溶液中所发生反应的离子方程式正确的是 ( )
A.向Ba(OH)2溶液中加入稀H2SO4溶液:Ba2++OH-+H++SO2-4===BaSO4↓+H2O
B.将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O====SO2-3+2HClO
C.碳酸钙与醋酸反应:CaCO3+2H+===Ca2++CO2↑+H2O
D.FeSO4溶液中加入H2O:4Fe2++2H2O2+4H+===4Fe3++4H2O
10.分类是学习和研究化学的一种常用的科学方法。下列分类合理的 ( )
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
④根据反应的热效应将化学反应分为放热反映和吸热反应
⑤根据分散系的稳定性大小将混合物分为胶体、溶液和浊液
A.只有②④ B.只有②③⑤ C.只有①②④ D.只有②③⑤
9.在下列给定条件的各溶液中,一定能大量共存的离子组是 ( )
A.含有0.1mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO-3
B.室温下,pH=1溶液中:Na+、Fe3+、NO-3、SO2-4
C.加入Al能放出H2的溶液中:NH+4、SO2-4、Cl-、HCO-3
D.由水电离的c(OH)-=10-13mol·L-1的溶液中:Ba2+、Cu2+、Cl-、NO-3
8.镍隔(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍隔电池的电解质溶液为

KOH溶液,其充、放电按下式进行:Cd(OH)2+2Ni(OH)2 Cd+2NiOOH+2H2O。
有关该电池的说法中,不正确的是 ( )
A.放电时,电解质溶液中的OH-向负极移动
B.充电过程是电能转化为化学能的过程
C.放电时,负极附近溶液的碱性不变
D.充电时阴极反应:Cd(OH)2+2e--→Cd+2OH-
7.设NA表示阿伏加德罗常数。下列说法中,不正确的是 ( )
A.标准状况下,22.4L氢气和氧气的混合气体,所含分子数为NA
B.1mol Al3+含有核外电子数为3NA
C.常温常压下,1mol氦气含有的原子数为NA
D.1 L mol·L-1FeCl3溶液中Fe3+的数目小于NA
6.化学知识在生产和生活中有着重要的应用。下列说法中,不正确的是 ( )
A.与铜质水龙头连接处的钢质水管易发生腐蚀
B.明矾常作为净水剂
C.金属钠、镁等活泼金属着火时,可以使用泡沫灭火器来灭火
D.发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com