
题目列表(包括答案和解析)
12.某无色溶液可能含有I-、Fe3+、Na+、SO32-四种离子中的一种或几种,向该溶液中
加入少量溴水,溶液仍呈无色,则下列关于该溶液组成的判断正确的是( )
①肯定不含Fe3+ ②肯定含I- ③可能含I- ④肯定含SO32- ⑤肯定含Na+ ⑥可能含Na+
A.①③④ B.③④⑥
C.①②④ D.①③④⑤
11.某学生设计了如下图所示的方法对A盐溶液进行鉴定:

由此分析,下列结论中不正确的是( )
A.A中一定有Fe3+ B.C中一定有Fe3+
C.A可能为Fe2(SO4)3 D.B一定为BaSO4
10.X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示,若Y原子的
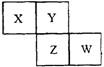 最外层电子数是内层电子数的3倍,下列说法正确的是( )
最外层电子数是内层电子数的3倍,下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.最高价氧化物对应的水化物的酸性:Z>W>X
C.相等物质的量浓度的气态氢化物水溶液的pH:X>Z>W
D.四种元素的单质中,W单质的熔点、沸点最高
9.设NA为阿伏加德罗常数,下列叙述正确的是( ) A.120℃时,22.4L水蒸气所含的分子数为NA
B.标准状况下,22.4L氩气所含的原子数为2NA
C.1L1mol/L的Na2CO3溶液中含有的离子总数小于3NA
D.常温常压下,46gNO2和N2O4的混和物所含原子总数为3NA
33.(8分)工业制纯碱时的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,获得碳酸氢钠晶体,第二步是利用碳酸氢钠制取纯碱。第一步的反应原理可以用以下的两个化学方程式表示,两个反应的总结果是放热反应。
NH3+CO2+H2O=NH4HCO3
NH4HCO3+NaCl(饱和)=NaHCO3(晶体)↓+NH4Cl
某校学生化学活动小组欲在实验室中模拟制纯碱的第一步过程,以获得碳酸氢钠晶体。可供选择的试剂有:6mol·L-1盐酸、6mol·L-1硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰。该小组学生设计的最简单的实验装置如下图:

(1)图中空白A处所用装置是(从装置I、II)中选择) 。
(2)请写出图中A、B、C、D处各仪器中盛放试剂的名称:
A B
C D
(3)装置D的作用是 。
(4)辅导教师指出要获得较多量的碳酸氢钠晶体,此套装置还有不足之处,请说明其原因并加以改进:
32.(8分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
 试回答下列问题:
试回答下列问题:
(1)请写出元素o的基态原子电子排布式
(2)第三周期8种元素按单质熔点高低的顺序如
右图,其中序号“8”代表 (填元素符号);
其中电负性最大的是 (填右图中的序号)。
(3)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为___ ____ ,一个晶胞中i原子的数目为_ _。
②该晶体的密度为____ ___(用字母表示)。
化学与技术模块
化学有机选模块
31.(8分)A、B、C、D、E 五种芳香化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示:
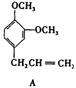
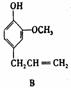


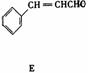
请回答下列问题:
(1)这五种化合物中,互为同分异构体的是 。 A的分子式为 。
(2)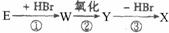
X能跟NaHC03溶液反应,能使溴的四氯化碳溶液褪色,且苯环上只有一个取代基。X的结构简式是 。与X互为同分异构体的是 (填序号)
反应①③的作用是 。
(3)E中的官能团有 。
(4)可用于鉴别A、B、E的是 。
① 银氨溶液 ② 溴的四氯化碳溶液 ③ 氯化铁溶液 ④ 氢氧化钠溶液
A.②与③ B.③与④ C.①与④ D.①与③
物质结构与性质模块
|
a |
|
|
|||||||||||||||
|
b |
|
|
|
c |
d |
e |
f |
|
|||||||||
|
g |
h |
i |
j |
|
k |
l |
m |
||||||||||
|
n |
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
30.(14分)A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如下图所示:

请回答下列问题:
(1)元素A在元素周期表中的位置为 周期 族。
(2)写出K的电子式 。
(3)写出H和D反应的化学方程式 。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式 。
(5)写出A与G反应的化学方程式 。
(6)K与E反应时产生的现象有 ;
该反应的化学方程式为 。
29.(14分)在实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应: 2A(g)+B(g)2C(g);△H =QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)
的变化情况如下表:
 实验 实验序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
8 0 0 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
8 0 0 ℃ |
n2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
8 0 0 ℃ |
n3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
7 3 0 ℃ |
1.0 |
0.90 |
0.80 |
0.75 |
0.70 |
0.65 |
0.65 |
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率为 mol/(L·min);实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q 0(填“>、=、<”),理由是
。
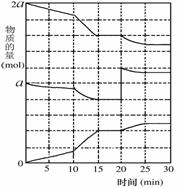 (2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如
右图所示,根据图中所示判断下列说法正确的_ _。
a.10-15 min可能是升高了温度
b.10-15 min可能是加入了催化剂
c.20 min时可能是缩小了容器体积
d.20 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA(g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的 。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的 。①a、b、c必须满足的关系是 , 。(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是 。
28.(14分)碱式碳酸镁有多种不同的组成,如:Mg2(OH)2CO3、Mg4(OH)2(CO3)3、
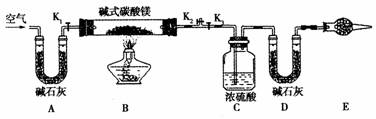 Mg5(OH)2(CO3)4等。某研究性学习小组的同学们为了确定某碱式碳酸镁的组成,设下图所示的实验装置。
Mg5(OH)2(CO3)4等。某研究性学习小组的同学们为了确定某碱式碳酸镁的组成,设下图所示的实验装置。
(1)实验步骤:
①按上图(夹持仪器未画出)组装好置后,首先进行的操作是_________。E处干燥管盛放的药品是________________。
②称取碱式碳酸镁样品m1g,并将其放入硬质玻璃管中;称量:装浓硫酸的洗气瓶C的质量为m2g;装碱石灰的U形管D的质量为m3g
③打开活塞___________,关闭__________缓缓鼓入空气数分钟。
④关闭活塞_______,打开__________,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,称职得洗气瓶C的质量为m4g;U形管D的质量为m5g。实验测得数据如下:m1 = 31g ,m2 =87.7g ,m3 = 74.7g,m4 = 89.4g ,m5 = 87.9g,计算推导:该碱式碳酸镁的化学式为_________________。
(2)关于该实验方案,以下说法你认为正确的是______________(填字母)
A.硬质玻璃管中有水凝结对测定结果有较大影响
B.不称量碱式碳酸镁样品的质量无法确定碱式碳酸镁的组成
C.该实验装置也可用于确定天然碱[aNa2CO3·bNaHCO3·cH2O(a、b、c为正整数)]的化学组成
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com