
题目列表(包括答案和解析)
5.下列物质①FeCl2 ②H2SO4 ③NH4NO3 ④HCl能通过化合反应直接制得的是 ( )
A.只有①②③ B.只有②③ C.只有①③④ D.全部
4.下列实验操作或事故处理中,正确的做法是 ( )
A.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
B.银镜反应实验后附有银的试管,可用稀H2SO4清洗
C.不慎将浓H2SO4沾在皮肤上,立即用NaOH溶液冲洗
D.在250mL烧杯中,加入216mL水和24g NaOH固体,配制10% NaOH溶液
3. 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ根据以上信息和数据,下列说法正确的是
( )
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ根据以上信息和数据,下列说法正确的是
( )
A.N4属于一种新型的化合物 B.N4与N2互为同素异形体
C.N4沸点比P4(白磷)高 D.1mo1N4气体转变为N2将吸收882kJ热量
2.SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02mg/L,下列措施中能够减少SO2排放量的是 ①用天然气代替煤炭做民用燃料 ②使用水煤气或干馏煤气做燃料 ③硫酸厂使用V2O5作催化剂,加快SO2的转化速率 ④将块状煤粉碎,提高其燃烧效率 ⑤在煤中加入石灰后燃用 ⑥循环处理吸收塔放出的尾气 ( )
A.①②③④⑤ B.①③⑤⑥ C.①②⑤⑥ D.②③④⑥
1.《科学》评出2004年10大科技突破,其中“火星上‘找’到水的影子”名列第一。下列关于水的说法中错误的是 ( )
A.用膜分离的方法可以使海水淡化 B.高效催化剂可使水分解,同时释放能量
C.密度小于1g/cm3的溶液,浓度越大,密度越小 D.金属的电化腐蚀中,水参与了正极反应
13.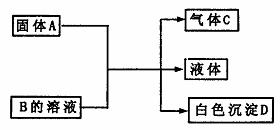 A、B、C、D、均为中学化学常见的物质,它们间的反应关系如下图所示。
A、B、C、D、均为中学化学常见的物质,它们间的反应关系如下图所示。
(1)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则B的化学式 。有关反应的化学方程式为 。
(2)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液。
①A是NaHCO3时,该反应的离子方程式为: 。
②A是一种淡黄色固体,且A与B以物质的量之比为2:1相混合时,推知B的化学式为 。
(3)若A是碳化钙(CaC2),A与B的溶液反应时只生成气体C、CaCO3和水;C的燃烧热为1300kJ·mol-1,则B的化学式为 ;C燃烧的热化学方程式为
12.A、B、C、D均为短周期主族元素,A、C、D在不同周期,A和C同主族,B、C同周期,A、B、C三种元素的原子序数之和为37,且B元素的最外层电子数与其电子层数相同,则:
(1)D元素的名称为 。
(2)写出元素A、D形成的化合物D2A的电子式 ,其熔点比D2C的熔点 (用“高”或“低”填写),理由是 。
(3)A、B、C三种元素所形成的常见化合物溶于水呈酸性,用离子方程式表示其原因 。
(4)A、B、C、D四种元素的原子半径从小到大的顺序为(用元素符号表示)
11. A、B、C、D、E均为短周期元素,且原子序数逐渐增大。A、D同主族,A与B的质子数之和等于C的质子数,A+离子与C2-离子的核外电子数之和等于D+离子的核外电子数,B原子与D+离子的核外电子数之和等于 E原子的核外电子数。
(1)A、B、C、D、E的元素符号分别为 。
(2)D、E元素可组成化合物甲,电解甲的水溶液时,反应的离子方程式为 ;A、C元素可组成原子个数比为1:1的化合物乙,将E单质通入乙的水溶液中,生成一种强酸,并有气体放出,反应的化学方程式为 。
(3)A、B、C、E中的任意三种元素可组成多种化合物,其中既含离了键又含共价键,且水溶液呈酸性的化合物有(写出两种化合物) 。
(4)A、C、D、E中的任意三种元素可组成多种化合物,其中溶于水时能抑制水电离的化合物有(各写一种不同类别的化合物) ,它们能抑制水电离的理由是 。
10.同周期中A、B、C、D、E、F为原子序数依次增大的短周期元素。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。请回答下列问题:
(1)根据以上条件一定能判断出的元素有几种,请在下列写出相对应的元素符号:
A B C D E F 。
(2)已知 D单质在 F单质中燃烧可能生成两种化合物,请分别写出生成两种化合物的化学方程式: ; 。
(3)若1 mol F的最高价氧化物水化物与C的最高价氧化物水化物恰好完全反应,则等物质的量的C的最高价氧化物与A的最高价氧化物水化物反应消耗 mol A的最高价氧化物水化物。
9. A、B、C是短周期主族元素,且原子序数依次增大,A元素的原子最外层电子数是次外层电子数的3倍,B和C的原子序数之和是A的原子序数的3倍,B和C形成的离子具有相同的电子层结构.试回答下列问题:
(1)C离子的结构示意图是___________________;由A和B形成的含有非极性键的离子化合物的电子式是___________________;
(2)B离子半径(填“<”或“>” ________C离子半径,B和C元素最高价氧化物的水化物之间反应的离子方程式为______________________________________;
________C离子半径,B和C元素最高价氧化物的水化物之间反应的离子方程式为______________________________________;
(3)化合物X由元素A、B、C组成,写出X的溶液与过量盐酸反应的离子方程式:
_____________________________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com