
题目列表(包括答案和解析)
27.食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
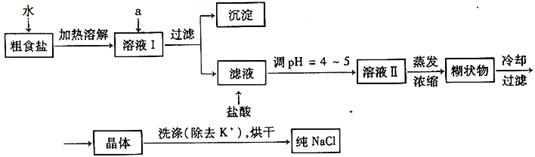
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为__________________________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_____________。
 (2)用提纯的NaCl配制500mL4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有_____________(填仪器名称)。
(2)用提纯的NaCl配制500mL4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有_____________(填仪器名称)。
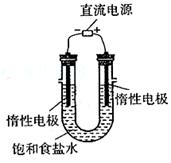
(3)电解饱和食盐水的装置如图所示,若收集的H2为
2L,则同样条件下收集的Cl2 _____(填“>”、
“=”或“<”=2L,原因是__________________
________。装置改进后,可用于制备NaOH溶液,若
测定溶液中NaOH的浓度,常用的方法为_________
_____________。
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑ MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置_____________(填代号)和制备并收集干燥、纯净Cl2的装置_____________(填代号)。
可选用制备气体的装置:

26.10℃时,在烧杯中加入0.1mol/L的 NaHCO3溶液400mL,加热,测得该溶液的pH发生如下变化:
|
温度(℃) |
10 |
20 |
30 |
50 |
70 |
|
pH |
8.3 |
8.4 |
8.5 |
8.9 |
9.4 |
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度_______(填“大于”或“小于”)NaHCO3 。

 (3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液的pH,若pH8.3_______(填“>”、“<”或“=”),说明甲正确,若pH 8.3(填“>”、“<”或“=”),说明乙正确。
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液的pH,若pH8.3_______(填“>”、“<”或“=”),说明甲正确,若pH 8.3(填“>”、“<”或“=”),说明乙正确。
(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断:
实验装置如右图,加热煮沸NaHCO3溶液,发现试管A中产生沉淀,说明 (填“甲”或“乙”)推测正确。
(5)资料:将一定体积0.1mol/L的 NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为9.8;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为10.1。据此资料可以判断 (填“甲”或“乙”)推测正确,原因是 。
25、铁及其化合物之间的相互转化可用下式表示:
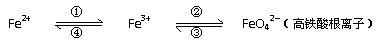
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4,在此反应中,氧化产物是 ;实验室若要保存该硫酸亚铁溶液要注意避免
用反应所得的酸性溶液,实现上述①的转化,要求产物纯净。可选用的试剂是 ;
a、Cl2 b、Fe c、O3 d、H2O2
(2)下述反应中,若FeSO4和O2的系数比为2:1,配平下列方程式:
FeSO4 + Na2O2 → Na2FeO4 + Na2O + Na2SO4 + O2↑
制备0.2mol Na2FeO4,转移电子_________mol;
(3)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成Fe(OH)3。高铁酸钾作为水处理剂发挥的作用是_______、_________。
24、工业制纯碱涉及到的部分反应如下:
NaCl+NH3+CO2+H2O
 NaHCO3↓+NH4Cl ①
NaHCO3↓+NH4Cl ①
CaCO3
 CaO+CO2↑②
CaO+CO2↑②
N2+3H2
 2NH3
③
2NH3
③
CaO+2NH4Cl
 CaCl2+2NH3↑+H2O ④
CaCl2+2NH3↑+H2O ④
2NaHCO3
 Na2CO3+H2O+CO2↑⑤
Na2CO3+H2O+CO2↑⑤
(1)氨碱法和联合制碱法共同使用的反应原理有 ,属于氨碱法单独使用的反应原理有 ,属于联合制碱法单独使用的反应原理有 。
(2)碳酸氢钠分解产生的二氧化碳可循环使用,但必须要补充,补充的主要原因是 ,但实际生产中补充量超过理论上反应耗用量,可能的原因是 。
(3)氨碱法需补充的二氧化碳一定来自 ,那么联合制碱需补充的二氧化碳可能来自 。
(4)侯德榜法在虑去碳酸氢钠的母液中加入氯化钠并通氨气时,会析出氯化铵的原因是 ,比起氨碱法采用氨循环,联合制碱法的两个突出优点是 , 。
23.下图是Zn和Cu形成的原电池,某实验兴趣小组做完试验后,在读书卡片上记录如下:
|

(1)在卡片上,描述合理的是 ( )
A.①②③ B. ④⑤⑥ C. ②③④ D. ③④⑤
(2)该原电池的总反应方程式 ,你所知道的构成原电池的条件是 ;
(3)生活中因为原电池反应而使得金属发生最常见的 这种电化学腐蚀,请列举两种方法来防止金属的电化学腐蚀 、
22、今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是 AB
A.K+一定存在 B.100mL溶液中含0.02mol CO32-
C.Cl-一定存在 D.Ba2+一定不存在,Mg2+可能存在
第Ⅱ卷(共84分)
21、新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为:
下列说法正确的是( )
A.上述反应为取代反应 B.滴定时可用淀粉溶液作指示剂
C.滴定时应剧烈振荡锥形瓶 D. 脱氢维生素C的分子式为C6H6O6
20、现有常温下的四种溶液(如下表),下列有关叙述中正确的是( )
|
|
① |
② |
③ |
④ |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
|
pH |
11 |
11 |
3 |
3 |
A.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
B.温度下降10℃,四种溶液的pH均不变
C.分别加水稀释10倍、四种溶液的pH:①>②>④>③
D.将①、④两种溶液等体积混合,所得溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
19、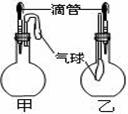 如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都有明显地胀大(忽略液体体积对气球的影响)。则所用试剂分别可能依次是( )
如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都有明显地胀大(忽略液体体积对气球的影响)。则所用试剂分别可能依次是( )
A.甲:浓硫酸和木炭 乙:浓氨水和SO2
B.甲:双氧水和MnO2 乙:NaOH溶液和CO2
C.甲:苯酚和Na2CO3溶液 乙:NaOH溶液和Cl2
D.甲:浓硫酸和蔗糖(滴有几滴水)乙:水和氨气
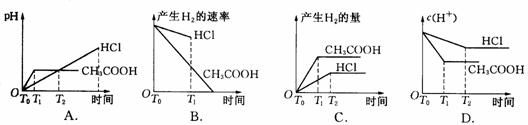
18、在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则下图所示比较符合客观事实的是( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com