
题目列表(包括答案和解析)
3.“混盐”是指一种金属离子与多种酸根离子构成的盐,如氯化硝酸钙[Ca(NO3)Cl]就是一种混盐。“复盐”是指含有多种简单阳离子和一种酸根阴离子的盐如KAl(SO4)2,下列各化合物中属于混盐的是
A.CaOCl2 B. NH4Fe(SO4)2 C.BiONO3 D.K3[Fe(CN)6]
2.下列关于胶体和溶液的叙述正确的是
A.溶液呈电中性,胶体带电荷
B.胶体是一种稳定的分散系
C.溶液中溶质微粒一定不带电,胶体中分散质微粒一定带电
D.通电后溶液中溶质微粒分别向两极移动,胶体中分散质微粒向某一极移动
1.下列有关说法正确的是
A.CaCl2、聚苯乙烯、HD均为化合物
B.CH2O2、C3H6O2、C4H8O2互为同系物
C.明矾、冰醋酸、硫酸钡均为电解质
D.SiO2、NaCl、S8、Cu均能表示物质分子组成
18.(14分)
(1)>(2分)  与Ca2+沉淀(2分)
与Ca2+沉淀(2分)
(2) ,
,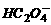 ,OH-,Cl-(2分)
,OH-,Cl-(2分)  +H+=
+H+=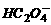 (2分)
(2分)
(3)生成草酸钙沉淀,使钙流失(2分)
(4)FeC2O4·H2O
 Fe + 2CO2↑+
H2O(2分)
Fe + 2CO2↑+
H2O(2分)
(5)C(2分)
17.(10分)
(1)CO2-3 +H2O -3+OH-(1分);
-3+OH-(1分);
c(Na+)+ c (H+)=2 c (CO32-)+ c (HCO3-)+ c (OH-)(1分)
(2)用pH试纸(或pH计)测常温下0.1mol·L-1 Na2CO3溶液的pH,若pH<12,则该同学的观点正确;若pH>12,则该同学的观点不正确。(2分)
(3) 8.0×10-9(2分)
(4)CO32-和HCO3-(1分); 1︰1(1分)
(5)CO32-+H+=HCO3- 1分); 6 (1分)
16.(16分)
(1)玻璃棒、滤纸(2分)
(2)CuO+2H+ == Cu2++H2O FeO+2H+ == Fe2++H2O(2分)
(3)Fe2+全部氧化为Fe3+ (2分)
(4)c、d(2分), 加入碱式碳酸铜或氧化铜后,不引入新的杂质,并可降低溶液中H+浓度, 控制溶液的pH在3.7~5.2之间,使Fe3+水解转化为Fe(OH)3,而Cu2+不水解(2分)
(5)在干燥的HCl气流中抑制Cu2+的水解,且带走CuCl2·xH2O受热产生的水气,故能得到无水氯化铜(2分)。
(6)3 (2分)
(7)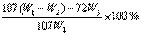 (2分)
(2分)
18.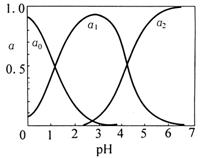 (14分)草酸(H2C2O4)是一种有机二元酸,
(14分)草酸(H2C2O4)是一种有机二元酸,
水溶液中草酸的存在形态有三种,各形态的
浓度分数α随溶液pH变化的关系如图所示:
(1)草酸钠溶液中, 2 (填“>”、
2 (填“>”、
“=”、“<”);往该溶液中滴入氯化钙溶液后,
 增加,可能的原因是
增加,可能的原因是
。
(2)往草酸钠溶液中滴稀盐酸,pH=5时溶液中存在的阴离子有 ,pH=3时,主要反应的离子方程式为 。
(3)菠菜富含草酸,菠菜不能与牛奶、豆腐一起食用的原因是
。
(4)将适量草酸亚铁(FeC2O4·H2O)粉末加入试管,在酒精灯上边加热边摇动,发生剧烈反应,产生的气体可使燃着的木条熄灭,生成黑色粉末。反应即将结束时,将所得的黑色粉末撒在石棉网上,便会立即燃起来。草酸亚铁受热分解的化学方程式为 。
(5)下表为几种酸对铁锈及锅炉水垢的溶解性的比较:
|
酸 |
铁锈[Fe(OH)3]溶解量/g |
水垢(CaCO3)溶解量/g |
|
盐酸 磷酸 草酸 醋酸 |
0.7911 0.1586 0.7399 0.1788 |
全溶 微溶 0.0036 0.1655 |
下列说法正确的有 。
A.相同物质的量浓度时,酸性越强的酸除铁锈效果越好
B.草酸除水垢效果差的原因是因为草酸酸性太弱
C.铁锈或水垢在酸中的溶解性与酸根离子的性质有关
D.硫酸除铁锈和水垢的效果都很好
17.(10分)常温下在20mL0.1mol/LNa2CO3
溶液中逐滴加入0.1mol/L HCl溶液40mL,
溶液的pH逐渐降低,此时溶液中含碳元
素的微粒物质的量浓度的百分含量(纵轴)
也发生变化(CO2因逸出未画出),如下
图所示。回答下列问题:
(1)20mL 0.1mol/LNa2CO3溶液呈碱性的原因是(用离子方程式表示): ;其溶液中所有阳离子和阴离子的浓度有何关系?(用等式表示) 。
(2)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确
。
(3)若向20mL 0.1mol/LNa2CO3溶液中加入BaCl2粉末3.328×10-7g时开始产生沉淀X,则KSP(X)= 。
(4)当加入盐酸使溶液PH为10时,混合液中含碳元素的离子有哪些? ,其物质的量之比为 。
(5)请写出OAB段的离子方程式 ;当混合液的pH= 时,开始放出CO2气体。
16.(16分)某化学研究性学习小组拟用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜并测定样品中氧化铜的质量分数,其实验流程如下:
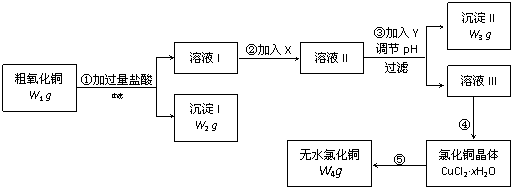

实验过程中的pH调节可参考下表:
|
物质 |
开始沉淀时的pH |
完全沉淀时的pH |
|
氢氧化铁 |
2.7 |
3.7 |
|
氢氧化亚铁 |
7.6 |
9.6 |
|
氢氧化铜 |
5.2 |
6.4 |
回答以下问题:
(1)步骤①过滤操作中所用仪器有铁架台(带铁圈)、漏斗、烧杯等,还需要使用的仪器用品有 。
(2)步骤①中发生的离子反应方程式 。
(3)步骤②溶液I中加入X的目的是 。
(4)试剂Y可选用(填字母) ,选择的原因是 。
a.氢氧化钠 b.氨水 c.碱式碳酸铜 d.氧化铜
(5)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2·xH2O,其原因是
。
(6) 经检测,CuCl2·xH2O中含水28.6%,则CuCl2·xH2O中x的值为 。
(7)若步骤④中有80% 的氯化铜转入晶体,其余各步转化都是完全的,请根据流程



15.绿色化学己成为当前化学研究的热点和前沿,旨在从源头上消除污染,实现经济和社会可持续发展。而常温离子液体(ionic liquid)(也有称常温熔融盐)以其优异的理化特性最有可能使上述理想变为现实。1914年报道的第一种离子液体硝酸乙基铵((C2H5NH3)NO3)离子液体其熔点为12℃。已知C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是
A.离子液体可以作为电池的电解质 B.硝酸乙基铵水溶液呈碱性
C.硝酸乙基铵水解的离子方程式或表示为:C2H5NH3++H2O=C2H5NH2+H3O+
D.相同温度下,相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH值小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com