
题目列表(包括答案和解析)
8. 答案解析:(中难)本题考查对热化学方程式的含义的理解,答案:C。根据物质燃烧热书写热化学方程式一定要符合燃烧热的概念要求,在101kPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。25℃、101 kPa下,水的“稳定”状态不是气态,应为液态,所以C错了。热化学方程式的化学计量数可以写成整数或分数。A、B 选项表示的是1molCO或HCOOH完全燃烧时所放出的热量,D选项表示的是2molCH3OH完全燃烧时所放出的热量,书写上都没有错误。
技能空间:在化学反应过程中放出或吸收的热量,通常叫做反应热。反应热用符号DH表示,单位一般采用kJ/mol。当DH为“-”或DH<0时,为放热反应;当DH为“+”或DH>0时,为吸热反应。
8. 25℃、101 kPa下,CO、HCOOH、CH4和CH3OH的燃烧热依次是67.6 kJ/mol、62.8kJ/mol、890.3 kJ/mol、726kJ/mol,则下列热化学方程式不正确的是( )
A.CO(g)+O2(g)=CO2(g);DH=-67.6 kJ/mol
B.HCOOH(1)+O2(g)=CO2(g)+H2O(1);DH=-62.8 kJ/mol
C.CH4g)+2O2(g)=CO2(g)+2H2O(g);DH=-890.3 kJ/mol
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);DH=-1452 kJ/mol
7. 答案解析:(中难)本题考查勒沙特列原理的应用,答案:C。根据左图所示,T2时达到平衡所需时间短,说明温度T2比T1高,因此降低温度平衡正向移动。加入催化剂,不会移动平衡。根据右图所示,P2时达到平衡所需时间短,说明压强P2比P1大,再分析纵坐标,可以看出压强越大C的物质的量分数越小,即增大压强平衡向n(c) %减小的逆向移动,即a<c+d。
7.可逆反应aA(g)+bB(s) cC(g)+dD(g)在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是( )
cC(g)+dD(g)在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是( )

A.温度降低,化学平衡向逆反应方向移动
B.使用催化剂,C的物质的量分数增加
C.化学方程式系数a<c+d
D.无法根据图像确定改变温度后化学平衡移动方向
6. 答案解析:(易)考查学生对化学基本概念的理解能力,物理变化和化学变化的区别是中学化学中必会的基础知识,答案为B。③缓慢氧化是物质发生氧化反应。④品红褪色,是品红与通入气体发生反应生成一种新物质。⑤无水硫酸铜自白变蓝是结合水生成了蓝矾。⑦白磷转化为红磷是生成了一种新单质。⑧浓硝酸久置分解出NO2,NO2又溶解在HNO3中,使得硝酸变黄。以上变化都有新物质生成,属于化学变化。
错点警示:本题尽管简单,但还是会有少部分同学出错,A是干扰性最大的选项。对于②,不能只考虑发生化学反应的爆炸现象,而忽略了属于物理变化的爆炸现象,如给自行车打气,打多了轮胎会爆炸等。
6.下列变化一定属于化学变化的是( )
①导电 ②爆炸 ③缓慢氧化 ④品红褪色 ⑤无水硫酸铜自白变蓝 ⑥工业制O2 ⑦白磷转化为红磷 ⑧久置浓硝酸变黄
A.②③④⑦⑧ B.③④⑤⑦⑧ C.②③⑥⑦ D.④⑤⑦⑧
27.答案解析:(难)在高温下,铁可与水蒸气发生反应,产物有Fe3O4和H2,产物Fe3O4可以与稀硫酸发生反应:Fe3O4+ 8H+══Fe2+ + 2Fe3+ + 4H2O。如果铁粉过量,还可发生:Fe+2Fe3+══3Fe2+,所以滤液中可能含有Fe3+,也可能不含Fe3+。检验溶液中含有Fe3+方法很多,最灵敏的方法是滴入几滴KSCN溶液,观察溶液颜色是否变红。Fe(OH)2不稳定,接触空气时很快被氧化成Fe(OH)3,要较长时间观察到白色沉淀的生成,关键是怎样降低反应体系中氧气的量,本题设计的装置能够成功地使Fe(OH)2长时间保持白色,关键在于用H2赶走了体系中的氧气。
27.(15分)常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。
(1)铁粉与水蒸气反应的化学方程式是: 。
(2)停止反应,待装置冷却后,取出反应过的还原铁粉混合物,加入过量的稀硫酸充分反应,过滤。简述检验所得滤液中Fe3+的操作方法: 。
(3)经检验上述滤液中不含Fe3+,这不能说明还原铁粉与水蒸气反应所得产物中不含+3价的Fe元素。原因是(结合化学方程式说明) : 。
(4)某同学利用上述滤液制取白色的Fe(OH)2、沉淀,向滤液中加入NaOH溶液后,观察至生成的白色的沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色→红褐色的化学方程式是: 。
②为了得到白色的Fe(OH)2沉淀,并尽可能长时间保持其白色,有人设计如下图所示装置:

请简述实验操作及原理: 。
26.答案解析:(中难)该题是以NaNO2的性质为主题对氧化还原反应和离子反应的综合考查,要求学生能根据题目所给信息和要求,结合生活常识及有关物质发生氧化还原反应规律、配平规则,离子方程式书写技巧寻找结论,并规范作答。题中反应须在酸性条件下进行,生活中食醋显酸性。NaNO2→N2是一个还原过程,需加入还原剂才能实现。参考答案归纳如下:
(1)x:2(2分) y:4 (2分)
(2)食醋 (3分)(或醋,答醋酸不得分)
(3)c (2分) NH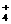 +NO
+NO ══N2↑+2H2O (3分)
══N2↑+2H2O (3分)
技能空间: 第(1)小题可根据原子(碘原子)守恒来确定x的数值,由于I2的系数是1,所以前面的系数x=2,当然也可根据得失电子守恒来确定x的数值。然后根据氧原子守恒得z=2,再根据氢原子守恒得y=4,当然也可根据电荷守恒来确定y的数值。离子氧化还原反应方程式,除了要符合质量守恒、电子得失守恒,还要符合电荷守恒,即离子反应方程式等号左右两边离子所带电荷总数相等。
26.(12分)工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3g-0.5g。已知NaNO2能发生如下反应(方程式已配平):
2NO +xI-+yH+══2NO↑+I2+zH2O,请回答下列问题:
+xI-+yH+══2NO↑+I2+zH2O,请回答下列问题:
(1)上述反应中,x的数值是 ,y的数值是 。
(2)根据上述反应,可用化学试纸的生活中常见物质进行实验来鉴别工业盐和食盐,现有碘化钾淀粉试纸,则还需选用的生活中常见物质的名称为 。
(3)某工厂废切削液中含有2%-5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是 ,
a.NaCl b.H2O2 c.NH4Cl d.浓H2SO4
所发生反应的离子方程式为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com