
题目列表(包括答案和解析)
2.钠与水的反应
(1)实验过程:①②③④

Na与水的反应
图2-7
(2)反应原理:2Na+2H2O=2NaOH+H2↑
(3)注意事项:取钠不要太大,钠块过大,会发生爆炸.
(4)实验现象:①钠与水剧烈反应、②钠熔化成小球、③钠球在水面上不停地滚动、④有气体生成,并发出嘶嘶声.
(5)实验结论:钠与水反应剧烈,生成碱并放出气体.
1.钠的物理性质
(1)实验过程
将钠用镊子从煤油中取出,用滤纸吸干煤油,然后在玻璃片上将钠用小刀切下一小块(豆粒大小),进行观察,并注意切面的变化.
(2)注意事项
①取钠时要用镊子夹取、不能用手拿,因为易与汗液反应,灼伤腐蚀皮肤.
②取出钠后要迅速吸干煤油,并要放到玻璃上切割.
③钠用剩后要放回盛钠的试剂瓶,不能乱扔乱放,因为钠很活泼容易引起危险.
④钠与O2反应很容易,在观察钠的颜色光泽时要在切割后立即观察.
(3)实验现象
切面银白色,但迅速变暗(4Na+O2=2Na2O等),失去金属光泽.
(4)实验结论
金属钠硬度很小(质软),具有银白色金属光泽,很容易被空气氧化.
4.焰色反应
这个实验是以不同的碱金属盐类呈现各自的特征焰色为基础的,为了能够便于观察,最好用无色火焰,所以用煤气灯较好,因煤气灯的火焰本身颜色较微弱,干扰较小.一般酒精灯火焰呈杂色,可向学生作适当说明,每做一次实验,都要把铂丝重新用稀盐酸和蒸馏水反复洗净,再在火焰上灼烧至无色,才可继续做实验.做焰色反应实验时,要把蘸有金属化合物溶液的铂丝放在灯焰外焰上灼烧,使形成的火焰较长,焰色反应现象比较明显.
焰色反应实验也可采用下述方法进行:
在铁丝(或玻璃棒)一端捆少量棉花,蘸些酒精,在酒精灯火焰上点燃,向燃着的棉花上滴钠盐或钾盐的溶液.
如无铂丝,可用无锈洁净的铁丝代替,也能得到较好的效果.
做焰色反应实验时,溶液的浓度大一些为好,浓度太小呈现的焰色很快消去,不易观察,做实验时,可以用铂丝蘸一些蒸馏水后再蘸一些盐的粉末,然后进行灼烧,这样效果更明显.
实验完毕,要把装在玻璃棒上的铂丝放在盐酸里浸渍2 min-3 min,再用蒸馏水洗净,保存在试管里,使它洁净无垢.
3.碳酸钠和碳酸氢钠与酸的反应
本实验也可采用下述方法进行:
取相同式样的100 mL细口瓶两只,各注入25 mL 1.0 moL·L-1 HCl溶液.再取两只气球,一只装入1.0 g无水碳酸钠,另一只装入1.0 g碳酸氢钠,分别套在两只细口瓶的口上.
实验时,掀起两只气球,使里面的固体全部落到细口瓶里的盐酸中,比较反应的剧烈程度,碳酸氢钠的反应剧烈得多,碳酸氢钠放出的气体也比碳酸钠多.
(1)钠的物理性质及钠跟水的反应
新切开的钠的断面是光亮的银白色,易跟氧起反应,但产物较复杂,如氧化钠(Na2O)、过氧化钠(Na2O2)等.
金属钠跟水反应生成氢气的实验,用拇指堵住试管口倒放入烧杯中,这样的操作对学生来讲,不熟练可能会使一部分空气进入试管.所以在正式做收集气体的实验之前,教师可安排学生练习几次放入试管的操作.如果操作还是有困难,可用一个与试管口大小合适的橡皮塞堵住试管口,放入水中后再拔去橡皮塞.本实验也可以用水槽代替烧杯,这样口径比较大,操作方便.
注意在实验时不能取用较大的钠块.这是因为钠的性质很活泼,它跟水反应时放出大量的热,甚至能使周围的水沸腾,因此钠同时也跟水蒸气反应.如果在水面上游动的钠被容器壁上的油污粘住,不能游动,放出的热不易扩散,会使氢气着火燃烧,甚至还会发生小爆炸,使生成的氢氧化钠飞溅出来.
(2)钠与氧气的反应
在做钠与氧气反应的实验时,为了保证倾斜的空气能够流通,玻璃管不能太细,而且装入玻璃管中的钠粒不能太大.待玻璃管中的钠受热溶化并开始燃烧时,稍稍倾斜玻璃管即可看到燃烧后由白色变为黄色的过程.实验时如果没有太粗的玻璃管,也可用去底的试管代替.注意本实验中所用的钠块,应去掉其表面的氧化物,否则燃烧时会使试管壁显黑色,影响对实验现象的观察.
2.碳酸氢钠受热分解
碳酸氢钠粉末在试管中应铺平些,这样受热比较均匀,分解也比较完全,澄清的石灰水变浑浊后,应将盛石灰水的试管移去,因为若通入过多的二氧化碳,会使生成的碳酸钙变成碳酸氢钙而溶解于水中,使浑浊现象消失.
当实验结束时,一定要先移去装有石灰水的烧杯,再熄灭酒精灯,以防止水倒流,使试管炸裂.
16.将一定量的CO2气体通入500 mL某NaOH溶液,充分反应后,将溶液在低温下蒸发,得到不含结晶水的白色固体A。取三份质量不同的该白色固体A分别与50 mL相同浓度的盐酸反应,得到气体的体积(标准状况)与固体A的质量关系如下表所示。
|
组别 |
1 |
2 |
3 |
|
盐酸的体积(mL) |
50 |
50 |
50 |
|
固体A的质量(g) |
3.80 |
6.20 |
7.20 |
|
气体体积(mL) |
896 |
1344 |
1344 |
(1)上表中第 组数据表明加入的50 mL盐酸反应后有剩余,其理由是 。
(2)请通过计算、讨论、判断固体A是什么物质,其成分的质量百分含量为多少?
15.使一定量的磷化氢和氢气的混合气体,依次通过两支加热的硬质玻璃管,第一支玻璃管中装有铜屑,第二支玻璃管中装有氧化铜,第一支试管中由于发生如下反应:2PH3+Cu Cu3P2(s)+3H2,玻璃管中物质的质量增加4.96 g,第二支玻璃管中物质的质量减少了5.76 g。(1)计算原混合气体中磷化氢和氢气的体积比。
Cu3P2(s)+3H2,玻璃管中物质的质量增加4.96 g,第二支玻璃管中物质的质量减少了5.76 g。(1)计算原混合气体中磷化氢和氢气的体积比。
(2)在标准状况下,原混合气体的密度是多少?
14.计算以下两小题时,除必须应用所有给出的数据外,还缺少一个数据,指出该数据的名称,并分别以a和b表示,列出计算式。
(1)在温度为t℃和压强为p Pa时,19.5 g A与11 g B恰好完全反应,生成固体C和3.00 L气体D,计算生成C的质量(m)。
缺少的数据是 ,计算式为m= 。
(2)0.48 g金属镁与10 mL盐酸反应,计算生成的H2在标准状况下的体积[V(H2)]。
缺少的数据是 ,计算式为 。
13.常温下,A和B两种物质组成的混合气体(A的式量大于B),经分析,混合气体中只有氮和氧两种元素,而且不论A、B以何种比例混合,氮和氧的质量比总大于 ,小于
,小于 ,由此可知A为
,B为
(写化学式),若上述混合气体中氮和氧的质量比为21∶20,则该混合气体中A和B的物质的量之比为
。
,由此可知A为
,B为
(写化学式),若上述混合气体中氮和氧的质量比为21∶20,则该混合气体中A和B的物质的量之比为
。
12.一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式为:
XY2(l)+3O2(g)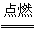 XO2(g)+2YO2(g)
XO2(g)+2YO2(g)
冷却后,在标准状况下测得生成物质的体积是672 mL,密度是2.56 g·L-1,则:
(1)反应前O2的体积是 。
(2)化合物XY2的摩尔质量是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com