
题目列表(包括答案和解析)
3.(2010年上海)下列反应的离子方程式正确的是

 w_w w. k#s5_
w_w w. k#s5_
A.苯酚与碳酸钠溶液的反应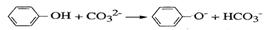
B.等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合
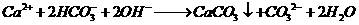
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液
Fe2++2H++H2O2→Fe3++2H2O2
D.淀粉碘化钾溶液在空气中变蓝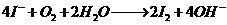
解析:本题主要考查了离子方程式的正误判断。苯酚的酸性弱于碳酸的强于HCO3-的,A对;等体积等浓度的碳酸氢钙和氢氧化钠溶液混合时,氢氧化钠不足量,离子方程式为:OH-+HCO3-+Ca2+=H2O+CaCO3↓,B错;反应前后的电荷不守恒,正确的离子方程式为:2Fe2++2H++H2O2→2Fe3++2H2O2,C错;空气中的氧气可以将I-氧化为I2,I2遇淀粉变蓝,D对。
答案:AD
2.(2010年全国1)能正确表示下列反应的离子方程式是

 w_w w. k#s5_
w_w w. k#s5_
A.将铜屑加入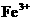 溶液中:
溶液中: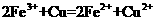
B.将磁性氧化铁溶于盐酸: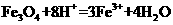
C.将氯化亚铁溶液和稀硝酸混合: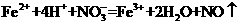
D.将铁粉加入稀硫酸中: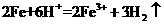
解析:本题主要离子方程式的正误判断。A正确,符合3个守恒;B错误,电荷不守恒,Fe3O4中Fe有两种价态,正确应该为:Fe3O4+8H+=2Fe3++Fe2++4H2O;C错误,得失电子不守恒,电荷不守恒;正确的应为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;D错误,不符合客观实际,反应后铁只能产生Fe2+和H2,正确的离子方程式为:2H++Fe=H2↑+Fe2+。
答案:A
1.(2010年天津)下列实验设计及其对应的离子方程式均正确的是
A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
B.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO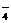 + 6H+ +
5H2O2 = 2Mn2+ + 5O2↑
+ 8H2O
+ 6H+ +
5H2O2 = 2Mn2+ + 5O2↑
+ 8H2O
解析:本题主要离子方程式的正误判断。B中元素不守恒,正确的离子方程式为:2Na2O2+2H2O==4Na++4OH-+O2↑;C中的HClO是弱酸,不能拆成离子形式,正确的离子方程式为:Cl2 + H2O =H+ + Cl- + HClO;D的离子方程式本身没有问题,但KMnO4的强氧化性能将浓盐酸氧化,不能实现证明H2O2具有还原性的目的(还原性:HCl>H2O2,HCl先反应),D错。
答案:A
4.(2010年江苏)常温下,下列各组离子在指定溶液中能大量共存的是

 w_w w. k#s5_
w_w w. k#s5_
A.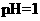 的溶液中W W W K S 5 U . C O M
的溶液中W W W K S 5 U . C O M
: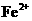 、
、 、
、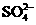 、
、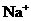
B.由水电离的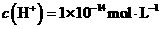 的溶液中:
的溶液中: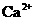 、
、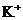 、
、 、
、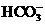
C.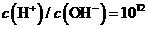 的溶液中:
的溶液中: 、
、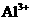 、
、 、
、
D. 的溶液中:
的溶液中: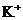 、
、 、
、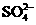 、
、
解析:本题主要考查的是离子共存问题。在酸性溶液中由于H+、NO3-与Fe2+发生氧化还原反应而不能大量共存,A错误;由题意知在该溶液中水的电离被抑制7,所以该溶液既可能显酸性也可能显碱性,但不论溶液显酸性还是显碱性,都能与HCO3-反应,所以选项B错误;根据水的离子积常数可以计算出该溶液中的c(H+)=0.1mol/L,即该溶液显酸性因此离子可以大量共存; Fe3+能与SCN-发生络合反应,因此不能大量共存。综上分析可知,本题选C项。
答案:C


 w_w w. k#s5_
w_w w. k#s5_
3. (2010年浙江)某钠盐溶液中可能含有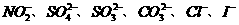 等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
等阴离子。某同学取5份此溶液样品,分别进行了如下实验:

 w_w w. k#s5_
w_w w. k#s5_
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN溶液,显红色
该同学最终确定在上述六种离子中共含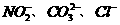 三种阴离子。
三种阴离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
A. ①②④⑤ B. ③④ C. ③④⑤ D. ②③⑤
解析:由实验④可知白色沉淀是BaCO3,气体是CO2,所以可以排除SO42-和SO32-;实验③可以证明含有Cl-,由于要放出有色刺激性气体,所以只能是亚硝酸的自身分解,反应的方程式为:2HNO2==H2O+NO↑+NO2↑。因此选项B正确。
答案:B
2.(2010年上海)下列离子组一定能大量共存的是
A.甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+
B.石蕊呈蓝色的溶液中:Na+、AlO2-、NO3-、HCO3-
C.含大量Al3+的溶液中:K+、Na+、NO3-、ClO-
D.含大量OH一的溶液中:CO32-、Cl-、F-、K+
解析:本题主要考查了化学实验中的离子共存问题。使甲基橙呈黄色的溶液pH大于4.4,而当其处于4.4-7之间时,NO3-表现强氧化性,将I-氧化为I2,A错;石蕊呈蓝色的溶液pH大于8,溶液呈碱性,OH-能和HCO3-反应,B错;含大量Al3+的溶液中,由于Al3+水解溶液呈酸性,其中的H+能和ClO-结合生成弱电解质HClO, C错。在强碱性溶液中CO32-、Cl-、F-、K+可以大量共存。
答案:D
1.(2010年安徽)在pH=1的溶液中,能大量共存的一组离子或分子是
A.Mg2+、Ca2+、ClO-、 B.Al3+、
B.Al3+、 、Br-、Cl-
、Br-、Cl-
C.K+、Cr2O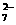 、CH3CHO、
、CH3CHO、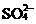 D.Na+、K+、
D.Na+、K+、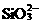 、Cl-
、Cl-
解析:A中 H+与ClO-反应生成HClO;C中CH3CHO被Cr2O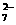 酸性溶液氧化;D中H+与
酸性溶液氧化;D中H+与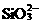 反应生成沉淀,所以选项B正确。
反应生成沉淀,所以选项B正确。
答案:B
7.(2010年海南)固硫剂是把煤燃烧时生成的二氧化硫以盐的形式固定在炉渣中的物质,可减少二氧化硫对大气的污染。下列物质中可用做固硫剂的有

 w_w w. k#s5_
w_w w. k#s5_
A.CaO B.Na2C03 C.NH4N03 D. P205
解析:二氧化硫是一种酸性氧化物,在所给的物质中能与二氧化硫反应的只有选项A、B。因此选项A、B正确。
答案:A、B


 w_w w. k#s5_
w_w w. k#s5_
6. (2010年山东)下列推断正确的是

 w_w w. k#s5_
w_w w. k#s5_
A.SiO2是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显弱酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
解析:SiO2是酸性氧化物,能与NaOH溶液反应,方程式为:SiO2+2NaOH=Na2SiO3
+H2O,正确;Na2O、Na2O2与CO2反应方程式分别为:Na2O+CO2= Na2CO3、2Na2O2+2CO2=2Na2CO3+O2,所以B错误;NO在空气中会发生反应2NO+O2=2NO2,C错误;
新制氯水显弱酸性但同时显强氧化性,因此向其中滴加少量紫色石蕊试液,溶液先变红
色然后变成无色,D错误。
答案:A
5.(2010年重庆)下列叙述正确的是

 w_w w. k#s5_
w_w w. k#s5_
A.铝制容器可盛装热的H2SO4
B.Agl胶体在电场中自由运动
C.K与水反应比Li与水反应剧烈
D.红磷在过量Cl2中燃烧生成PCl3
解析:本题主要考察物质的性质。A项,铝与热的浓硫酸反应,错误。B项,AgI胶体因吸附电荷而其胶粒带电,故在电场作用下做定向移动,错误。C项,K比Li活泼,故与水反应剧烈,正确。D项,P与过量的Cl2反应,应生成PCl5,错误。
答案C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com