
题目列表(包括答案和解析)
30. 2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
8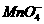 +5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O
6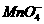 +5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:

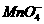 +
+ Fe2++
Fe2++ H+
H+ Mn2++
Mn2++ Fe3++
Fe3++ H2O
H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为_________mol。
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)的质量为_________ g。
(4)混合物中Cu2S的质量分数为_________。
29.已知下列变化过程中,0.2 mol RxO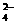 参加反应时,共转移0.4 mol电子。
参加反应时,共转移0.4 mol电子。
RxO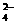 +MnO
+MnO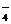 +H+
+H+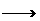 RO2+Mn2++H2O
RO2+Mn2++H2O
(1)x值为__________。
(2)参加反应的H+的物质的量为__________mol。
28.绿矾在强热条件下分解,生成H2SO4、SO2、Fe2O3和H2O,每生成1 mol H2SO4时,分解绿矾的物质的量是__________________。
27.已知Cu2S与某浓度的HNO3反应时,生成Cu(NO3)2和H2SO4,若反应中Cu2S与HNO3的质量比为320:819,则该反应的还原产物为__________________。
26. ① 在淀粉碘化钾溶液中,滴加少量次氯酸钠溶液,立即会看到溶液变蓝色,这是因为_____________,离子方程式为____________________。
② 在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠溶液,发现蓝色逐渐消失,这是因为__________________,离子方程式是____________________。
③ 对比①和②实验所得的结果,将I2、ClO-、SO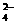 按氧化性由强到弱的顺序排列为___________________。
按氧化性由强到弱的顺序排列为___________________。
25. 智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
(1)反应中_____________元素被氧化,_____________是氧化剂。
(2)用短线标出电子转移方向和总数。
(3)反应产物中,所得氧化产物与还原产物质量之比为_____________。
24.配平化学方程式
KMnO4+FeS+H2SO4--MnSO4+Fe2(SO4)3+S↓+K2SO4+H2O
18.根据以下叙述,回答(A)、(B)、(C)三个小题。
X、Y、Z是主族元素的单质。U、V是化合物。它们有如下反应(式中各物质的系数和反应条件已一概略去)
①X+U V+Y ②X+Z
V+Y ②X+Z V ③Y+Z
V ③Y+Z U
U
(A)写出①式和②式各自所属的反应类型。
(B)若X和Y的组成元素,不是同一族。请写出符合①式的3个不同的化学方程式,并配平。3个式子中的3种X和3种Y,分别由不同族的元素组成。
________________________________________________
________________________________________________
(C)今有某化合物W,它跟化合物U或CO2反应,都能生成单质Y。符合该条件(题设的3个“通式”)的单质X是________,单质Y是________,单质Z是________,化合物V是________。
17.在下列各元素组中,除一种元素外,其余都可以按某种共性归属一类。请选出各组的例外元素,并将该组其它元素的可能归属,按所给6种类型的编号填入表内。
|
元素组 |
例外元素 |
其它元素所属类型编号 |
|
(a)S N Na Mg |
|
|
|
(b)P Sb Sn
As |
|
|
|
(c)Rb B Te Fe |
|
|
归属类型:(1)主族元素(2)过渡元素(3)同周期元素(4)同族元素(5)金属元素(6)非金属元素
16.已知1个N2O3分子的质量为a kg,1个N2O5分子的质量为b kg,若以1个氧原子( )质量的1/16作为相对原子质量的标准,则NO2的式量为________。
)质量的1/16作为相对原子质量的标准,则NO2的式量为________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com