
题目列表(包括答案和解析)
2.(03年江苏高考题)若以ω1和ω2分别表示浓度为a mol·L-1和b mol·L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)( )
A 2ω1=ω2 B 2ω2=ω1 C ω2>2ω1 D ω1<ω2<2ω1
思维方法: 。
物质的量浓度基础知识
(1)溶液的稀释:
①V1p1×W1%= V2p2×W2% 或W液×W1%=(W液+W水)×W2%(溶质的质量守恒)
②C1V1=C2V2(溶质的物质的量守恒)
(2)溶液混合:C V=C2V2+C1V1(溶质的质量守恒)。
[例题解析]
[例1]某无水易溶盐X,摩尔质量为M g/mol,其溶解度为Sg.取其Wg加入VL
蒸馏水,配制成密度为d g/mL,质量百分浓度为A%,物质的量浓度为Cmol/L的澄
清溶液.下式表示正确的是
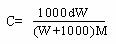
A.1000d×A%=C×M B.
C.S=100W/1000V D.A%=W/(W+1000V)%]
解题思路: 。
易错点: 。
[例2 ]已知98%的浓H2SO4的浓度为18.4mol· L-l,则49%的硫酸溶液的浓度为 ( )
A.等于9.2mol·L-1 B.大于9.2mol·L-1
C.小于9.2mol·L-1 D.不能确定
解题思路: 。
易错点: 。
[考题再现]
1.(03年江苏高考题)质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水,得到的溶液每毫升质量为qg,物质的量浓度为c。则溶质的分子量(相对分子质量)为( )
A
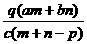 B
B 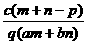 C
C 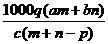 D
D 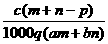
思维方法: 。
|
物理量 |
质量分数 |
物质的量浓度 |
溶解度 |
|
溶质单位 |
|
|
|
|
溶液单位 |
|
|
|
|
单
位 |
|
|
|
|
数值上关系 |
质量分数相同的两溶液其物质的量浓度一般 等. |
物质的量浓度相同的两溶液其质量分数一般 等. |
溶质溶解度相同的两溶液其在同一温度下饱和溶液的质量分数 等. |
|
定 义 |
|
|
|
|
符号 |
|
|
|
|
表达式 |
|
|
|
|
相同点 |
都能示溶质和溶液的相对比值 |
||
|
转化关系 |
|
2.c、 %、ρ之间的计算关系
%、ρ之间的计算关系 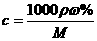
1.物质的量浓度的计算
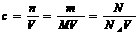
2. 物质的量浓度溶液的配制
(1) 容量瓶
①特点:
②用途: 。容量瓶有各种不同规格,
常用的规格有100mL、250mL、500mL和1000mL等。
(2)配制一定体积物质的量浓度溶液的步骤及所用仪器如下:
(3)配制物质的量浓度溶液时,应注意的问题:
。
1.物质的量浓度
(1)概念:
(2)符号:
(3)单位:
(4)说明:
①物质的量浓度是溶液的体积浓度
②溶液中的溶质既可以为纯净物又可以为混合物,还可以是指某种离子或分子。
3、同位素 ⑴定义: ⑵性质: a. 同一元素的各种同位素虽然质量数不同,但它们的 几乎完全相同。 b. 天然存在的某种元素里,各种同位素所占的 一般是不变的。 c. 使用同一元素符号。 d. 在 中处于同一位置。 (3)核素:
如:H、D、T是氢元素的三种核素。 4、原子核外电子排布 ⑴.核外电子运动特征: a.电子质量 ,运动空间很 ,但电子运动速度 ,接近光速(3×108m/s) b.高速运动时,不能找到运动轨迹,不能准确地测量和计算出电子的确切位置。 ⑵.电子云:表示
⑶.核外电子排布规律: a.各电子层最多容纳电子数目: b.最外层电子数目不超过 个,(K层为最外层时,不超过 个)。 c.次外层电子数目不超过 个,倒数第三层电子数目不超过 个。
d.核外电子总是尽先排布在 的电子层,然后按能量高低依次排布 例:1-18号元素原子核外电子排布特点 (1)1-2号元素只有K电子层,有 个电子;3-10号元素的原子各有 个电子层,
最外层为 个电子,11-18号元素原子次外层(L层) 个电子。 练习:画原子结构示意图:
O Cl- K+
2、数量关系
⑴质量数(A)= +
⑵质子数(Z)= = = =
⑶电子层数 = ; 最外层电子数 =
1、原子组成(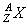 )
中子( 个):决定
的种类
)
中子( 个):决定
的种类
核外电子(带负电荷) 个:决定元素的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com