
题目列表(包括答案和解析)
(五)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使G中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有同学提出在B与G之间加入一个装置。再次实验后,得到了较正确的结果。那么,原来实验所测得的钢的质量分数偏小的原因可能是_________,在B与G之间加入的装置可以是________________,其中盛放的药品是_____________
27.我国规定饮用水质量标准必须符合下列要求:
|
pH值 |
Ca2+、Mg2+总浓度 |
细菌总数 |
|
6.5~8.5 |
<0.0045 mol/L |
<100个/mL |
以下是源水处理成自来水的工艺流程示意图:
源水¾®曝气池¾加入 石灰®一级沉降池¾®二级沉降池¾®过滤池¾通入 气体A ®自来水
(1)源水中含Ca2+、Mg2+、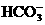 、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式______________________________
、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式______________________________
(2)凝聚剂除去悬浮固体颗粒的过程_____
① 只有物理过程 ② 只是化学过程 ③ 是物理和化学过程
FeSO4·7H2O常用的凝聚剂,它在水中最终生成__________沉淀。
(3)通入二氧化碳的目的是__________和__________
(4)气体A的作用是________。这种作用是基于气体A和水反应的产物具有______性。
(5)下列物质中,_____可以作为气体A的代用品。
① Ca(ClO)2 ② NH3(液) ③ K2FeO4 ④ SO2
2001年
(三)实验内容:
|
实验过程 |
实验现象 |
有关化学方程式 |
|
在C中加入样品标本W克,D中装入精品后并称量为m克。连接好仪器后,检查气密性。 |
|
|
|
打开A的活塞,慢慢洋加溶液。 |
|
|
|
对G进行加热。当G中药品充分反应后。关闭A的活塞。停止加热。 |
|
|
|
冷却后,称量D的质量为m2克。 |
|
|
计算:样品中铜的质量分数=____________________(用含W、m1、m2的代数式表示)
26.某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。
(1)实验目的:_____________________________
(2)实验用品:仪器:天平、分液漏斗、锥形瓶、硬玻璃管、干燥管、酒精灯、洗气瓶
药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰、浓硫酸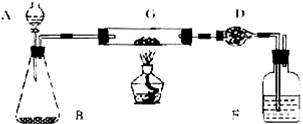
22.由5 mol Fe2O3、4 mol Fe3O4和3 mol FeO组成的混合物,加纯铁1 mol并在高温下和Fe2O3反应。若纯铁完全反应,则反应后混合物中FeO与Fe2O3的物质的量之比可能是
A.4:3 B.3:2 C.3:1 D.2:l
21.甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL 0.1 mol/L AlCl3溶液,两烧杯中都有沉淀生成。下列判断正确的是
A.甲中沉淀一定比乙中的多 B.甲中沉淀可能比乙中的多
C.甲中沉淀一定比乙中的少 D.甲中和乙中的沉淀可能一样多
20.几种短周期元素的原子半径及主要化合价如下表。下列叙述中正确的是
|
元素代号 |
X |
Y |
Z |
W |
|
原子半径/pm |
160 |
143 |
70 |
66 |
|
主要化合价 |
+2 |
+3 |
+5、+3、-3 |
-2 |
A.X、Y元素的金属性:X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
19.下列反应的离子方程式正确的是
A.苯酚与碳酸钠溶液的反应:
C6H5OH+CO32-¾®C6H5O-+HCO3-
B.等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:
Ca2++2HCO3-+2OH-¾®CaCO3¯+CO32-+2H2O
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2¾®Fe3++2H2O
D.淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O¾®2I2+4OH-
18. 右图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是
右图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是
A.烧瓶中立即出现白烟
B.烧瓶中立即出现红棕色
C.烧瓶中发生的反应表明常温下氨气有还原性
D.烧杯中的溶液是为了吸收有害气体
17.据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)。下列叙述错误的是
CH3CH2OH(g)+3H2O(g)。下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
16.下列溶液中微粒浓度关系一定正确的是
A.氨水与氯化铵的pH=7的混合溶液中:[Cl-]>[NH4+]
B.pH=2的一元酸和pH=12的一元强碱等体积混合:[OH-]=[H+]
C.0.1 mol/L的硫酸铵溶液中:[NH4+]>[SO42-]>[H+]
D.0.1 mol/L的硫化钠溶液中:[OH-]=[H+]>[HS-]>[H2S]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com