
题目列表(包括答案和解析)
30.超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:
Al2O3+N2+3C¾高 温®2AlN+3CO
由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
(1)称取10.00 g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36 L(标准状况)。
① 上述反应的化学方程式为_______________________
② 该样品中的A1N的质量分数为__________
(2)另取10.00g样品置于反应器中,通入2.016 L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34 g/L(已折算成标准状况,AIN不跟O2反应)。该样品中含杂质炭_____g。
31.硫铁矿高温下空气氧化产生二氧化硫:4FeS2+11O2¾®8SO2+2Fe2O3
设空气中N2、O2的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:
(1)1.00 mol FeS2完全氧化,需要空气的体积(标准状况)为_____L;
(2)55 L空气和足量FeS2完全反应后,气体体积(同温同压)变为_____L;
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
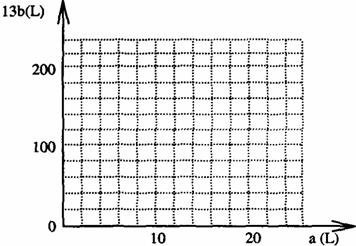
(4)设FeS2氧化产生的气体混合物为100 L,其中O2为a L,SO2为b L。
① 写出a和b的关系式;
② 在右图中画出a和b的关系曲线(FeS2氧化时,空气过量20%)
2003年
30.某化学课外小组用含铜96%的废铜屑制取胆矾(五水合硫酸铜)。将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫酸铜。
(1)写出生成硫酸铜的化学方程式________________________________________
(2)现用1 kg这种废铜屑理论上能制取胆矾多少千克?
(3)将胆矾与生石灰、水按质量比依次为1:0.56:100混合配制成无机铜杀菌剂波尔多液。
① 此波尔多液中Cu2+离子和Ca2+离子的物质的量比为_____(最简整数比)。
② 波尔多液有效成分的化学式可表示为CuSO4·xCu(OH)2·Ca(OH)2,此种配比当x=1时,试确定y的数值。
31.已知Fe2O3在高炉中有下列反应:Fe2O3+CO¾®2FeO+CO2
反应形成的固体混和物(Fe2O3、FeO)中,元素铁和氧的质量比用 mFe︰mO表示。
(1)上述固体混和物中,mFe︰mO不可能是_____
(a)21︰9 (b)21︰7.5 (c) 21︰6
(2)若mFe︰mO=21︰8,计算Fe2O3被CO还原的百分率。
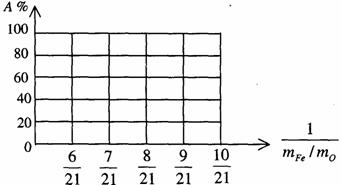
(3)设 Fe2O3被CO还原的百分率为A%,则A%和混和物中mFe︰mO的关系式为(用含mFe、mO的代数式表示)。A%=____________________
请在下图中画出A%和mFe/mO关系的图形。
(4)如果 Fe2O3和CO的反应分两步进行:
3Fe2O3+CO¾®2Fe3O4+CO2;Fe3O4+CO¾®3FeO+CO2
试分析反应形成的固体混和物可能的组成及相应的mFe︰mO(令mFe︰mO=21︰a,写出a的取值范围)。将结果填入下表。
|
混和物组成(用化学式表示) |
a的取植范围 |
|
|
|
2002年
30.为了预防碘缺乏病,国家规定每千克食盐中应含有40-50毫克的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428克,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030 mol/L的硫代硫酸钠溶液滴定,用去18.00 mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下: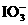 +5I-+6 H+¾®3I2+3H2O;I2+2
+5I-+6 H+¾®3I2+3H2O;I2+2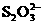 ¾®2I-+
¾®2I-+
33.某天然碱(纯净物)可看作由CO2和NaOH反应后的产物所组成。称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30 mL,产生CO2的体积(标准状况)如下表:
|
|
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
|
盐酸液的体积(mL) |
30 |
30 |
30 |
30 |
|
样品(g) |
3.32 |
4.15 |
5.81 |
7.47 |
|
二氧化碳的体积(mL) |
672 |
840 |
896 |
672 |
(1)由第_____组数据中的CO2体积与样品质量之比,可以推测用2.49 g样品进行同样的实验时,产生CO2_____mL(标准状况)。
(2)另取3.32 g天然碱样品于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2 112 mL(标准状况)和水0.45 g,计算并确定该天然碱的化学式。
已知Na2CO3和HCL(aq)的反应分下列两步进行:
Na2CO3+HCl¾®NaCl+NaHCO3 Na2CO3+HCl¾®NaCl+CO2+H2O
(4)依据上表所列数据以及天然碱的化学式,讨论并确定上述实验中CO2(标准状况)体积V(mL)与样品质量W(g)之间的关系式。
2001年
32.美籍埃及人泽维尔用激光闪烁照相机拍摄到化学反应中化学键断裂和形成的过程,因而获得1999年诺贝尔化学奖。激光有很多用途,例如波长为10.3微米的红外激光能切断B(CH3)3分子中的一个B-C键,使之与HBr发生取代反应:
B(CH3)3+HBr¾10.3微米的红外激光®B(CH3)2Br+CH4
而利用9.6微米的红外激光却能切断两个B-C键,并与HBr发生二元取代反应。
(1)试写出二元取代的代学方程式:__________________________________________
(2)现用5.6 g B(CH3)3和9.72 g HBr正好完全反应,则生成物中除了甲烷外,其他两种产物的物质的量之比为多少?
27.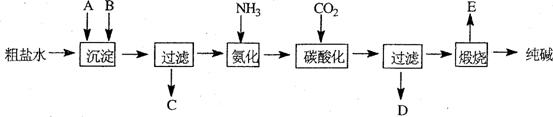 工业生产纯碱的工艺流程示意图如下:
工业生产纯碱的工艺流程示意图如下:
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。 A B
(2)实验室提纯粗盐的实验操作依次为:取样、__________、沉淀、__________、__________、冷却结晶、__________、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是 。碳酸化时没有析出碳酸钠晶体,其原因是
(4)碳酸化后过滤,滤液D最主要的成分是 _ (填写化学式),检验这一成分的阴离子的具体方法是:
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为: ,滤液D加石灰水前先要加热,原因是
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:
(注明你的表达式中所用的有关符号的含义)
26.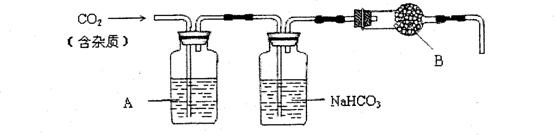 CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
完成下列填空:
(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6 mol/L),应选用的仪器是_____。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
(2)上述装置中,A是__________溶液,NaHCO3溶液可以吸收__________
(3)上述装置中,b物质是_____。用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果__________(填“偏高”、“偏低”或“不受影响”)。
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重¾®浸泡溶解¾®过滤¾®残渣烘干¾®冷却、称重¾®恒重
为了将石蜡和碳酸钙溶出,应选用的试剂是_____
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d 正已烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出________,后溶出__________
(6)上述测定实验中,连续__________________________________________________,说明样品已经恒重。
27. 实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
 (1)溶解大理石时,用硝酸而不同硫酸的原因是_______________________________
(1)溶解大理石时,用硝酸而不同硫酸的原因是_______________________________
 (2)操作Ⅱ的目的是______________,溶液A(溶质是共价化合物)是___________
(2)操作Ⅱ的目的是______________,溶液A(溶质是共价化合物)是___________
 (3)写出检验滤液中是否含铁离子方程式:_____________________________________
(3)写出检验滤液中是否含铁离子方程式:_____________________________________
 (4)写出加入碳酸铵所发生反应的离子方程式:________________________________
(4)写出加入碳酸铵所发生反应的离子方程式:________________________________
 写出滤液B的一种用途:________________
写出滤液B的一种用途:________________
 (5)CaO2中一般含CaO。试按下列提示完成CaO2含量分析的实验设计。
(5)CaO2中一般含CaO。试按下列提示完成CaO2含量分析的实验设计。
 试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞;仪器:电子天平、锥形瓶、滴定管。
试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞;仪器:电子天平、锥形瓶、滴定管。
 实验步骤:
实验步骤:
 ① __________;② 加入_______________;③
加入酚酞,用氢氧化钠标准溶液滴定。
① __________;② 加入_______________;③
加入酚酞,用氢氧化钠标准溶液滴定。
 (6)若理论上滴定时耗用标准溶液20.00 mL恰好完全反应,实际操作中过量半滴(1 mL溶液为25滴),则相对误差为__________
(6)若理论上滴定时耗用标准溶液20.00 mL恰好完全反应,实际操作中过量半滴(1 mL溶液为25滴),则相对误差为__________
 硝酸 A Fe(OH)3 (NH4)2CO3 滤液B
硝酸 A Fe(OH)3 (NH4)2CO3 滤液B
大理石¾®溶解¾®操作II¾®过滤¾®沉淀反应¾®过滤¾®CaCO3
2010年
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com