
题目列表(包括答案和解析)
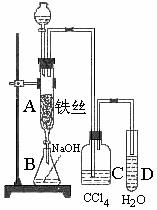
26.(B)某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式_______________________
(2)观察到A中的现象是_____________________________
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是______________,写出有关的化学方程式:______________________
(4)C中盛放CCl4的作用是__________
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_________,现象是___________________________
26.(A)我国化学侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
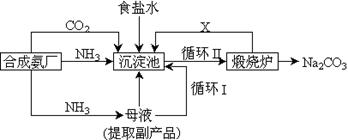

(1)上述生产纯碱的方法称,副产品的一种用途为__________
(2)沉淀池中发生的化学反应方程式是________________________________________
(3)写出上述流程中X物质的分子式_____
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了_____(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是_____
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加__________
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有_____
 (a)增大
(a)增大 的浓度,使NH4Cl更多地析出
的浓度,使NH4Cl更多地析出
(b)使NaHCO3更多地析出
(c)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
27.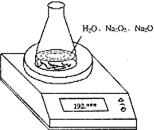 某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560 g、锥形瓶和水的质量为190.720 g),利用左图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560 g、锥形瓶和水的质量为190.720 g),利用左图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
(1)写出Na2O2和H2O反应的化学方程式____________
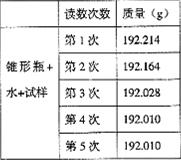 (2)计算过氧化钠质量分数时,必需的数据是________
(2)计算过氧化钠质量分数时,必需的数据是________
不必作第6次读数的原因是__________
(3)测定上述样品(1.560 g)中Na2O2质量分数的另一种方案,其操作流程如下:
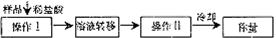
① 操作Ⅱ的名称是
② 需直接测定的物理量是
③ 测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要________、________。
④ 在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果_____(填:偏大、偏小或不变)。
2005年
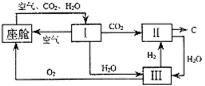
26.航天飞行器座舱内空气更新过程如图所示:
(1)Ⅱ是CO2和H2的反应装置,该反应的化学方程式___________________________
(2)从装置Ⅰ、Ⅱ、Ⅲ可看出,O2的来源是CO2和H2O,宇航员每天消耗28 mol O2,呼出23 mol CO2,则宇航员每天呼出的气体中含H2O_____mol。
(3)以下是另一种将CO2转化为O2的实验设想:
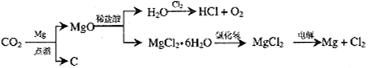
其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:
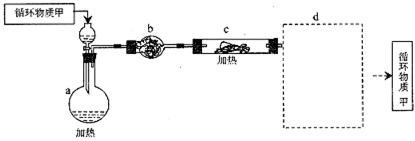
① 上图中,装置a由__________、__________、双孔塞和导管组成;
② 循环物质甲的名称是__________
③ 制取无水氯化镁必须在氯化氢存在的条件下进行,原因是____________________
④ 装置b中填充的物质可能是_____
c.硅胶 f.碱石灰 g.无水氯化钙 h.浓硫酸
⑤ 设计d装置要注意防止倒吸,请在方框中画出d装置的简图,并要求与装置c的出口处相连(铁架台不必画出)。
27.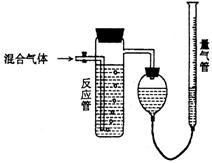 工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):
工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):
SO2+I2+2H2O¾®H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等于__________的体积(填气体分子式)。
(2)反应管内溶液蓝色消失卮,没有及时停止通气,则测得的SO2含量_____(填:偏高、偏低、不影响)。
(3)反应管内的碘的淀粉溶液也可以用 代替(填写物质名称)。
(4)若碘溶液体积为Va mL,浓度为c mol/L,N2与O2的体积为Vb mL(已折算为标准状况下的体积)。用c、Va、Vb表示SO2的体积百分含量为:____________________
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为__________
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
 2004年
2004年
26.实验室有CuO和Cu粉的混合物。请你利用给出的实验仪器及试剂,设计两种测定该样品(已称得其质量为m克)中氧化铜质量分数的方法,并填写表格中的有关内容。
|
实验 方法 |
实验过程中所发生反应的 化学方程式 |
实验所用仪器 (用编号表示) |
实验需直接测定的有关物理量 (用文字说明) |
|
1 |
|
|
|
|
2 |
|
|
|
实验可能用到的主要仪器:
① 托盘天平 ② 启普发生器 ③ 硬质玻璃管 ④ 泥三角 ⑤ 烧杯
⑥ 坩埚 ⑦ 酒精灯 ⑧ 玻棒 ⑨ 漏斗 ⑩ 干燥管
实验可能用到的试剂:
a.锌粒 b.稀硫酸 c.氯化钠溶液 d,浓硫酸
26.为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。
请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式_______________________
(2)甲同学设计的实验_____(填:能、不能)验证乙炔与澳发生加成反应,其理由是_____
(a)使溴水褪色的反应,未必是加成反应 (b)使溴水褪色的反应,就是加成反应
(c)使溴水褪色的物质,未必是乙炔 (d)使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是_____,它与溴水反应的化学方程式是_______________________________;在验证过程中必须全部除去。
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填
 入方框,并写出装置内所放的化学药品。
入方框,并写出装置内所放的化学药品。
¾® b ¾® ¾® d
(电石、水)( )( )(溴水) (a) (b) (c) (d)
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是 。
27.利用天然气合成氨的工艺流程示意如下:
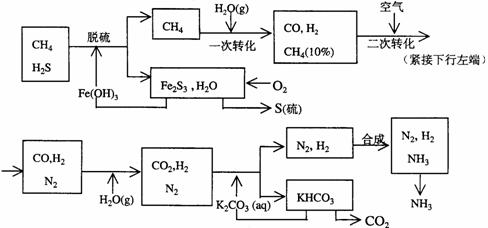
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是________________________________
(2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2_________mol(含n的代数式)
(3)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是_____
(a)相似相溶原理 (b)勒沙特列原理 (c)酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于______________(写出CO2的一种重要用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
2002年
26.用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.l mol/L的溶液100 mL;
② 用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100 mL;
② 分别取这两种溶液各10 mL,加水稀释为100 mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现 象,即可证明HA是弱电解质。
(1)在两个方案的第 ① 步中,都要用到的定量仪器是__________
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH_____(填:>、<、=)。
乙方案中,说明HA是弱电解质的现象是_____
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处_______________________________
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com