
题目列表(包括答案和解析)
26. 根据硫化氢气体的实验室制法和性质完成下列填空。
根据硫化氢气体的实验室制法和性质完成下列填空。
 (1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用_____
(1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用_____
 a.稀硫酸与硫化亚铁
b.稀硝酸与硫化亚铁
a.稀硫酸与硫化亚铁
b.稀硝酸与硫化亚铁
 c.稀硫酸与硫化钠
d.稀盐酸与硫化亚铁
c.稀硫酸与硫化钠
d.稀盐酸与硫化亚铁
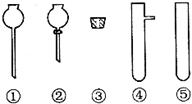
 (2)现要组装一套可以控制硫化氢气体产生速率的装置,请在下图中选择合适的仪器_____
(2)现要组装一套可以控制硫化氢气体产生速率的装置,请在下图中选择合适的仪器_____






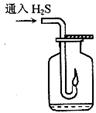
 (3)如右图,在一个充满氧气的集气瓶中加入少量品红稀硫溶液,
(3)如右图,在一个充满氧气的集气瓶中加入少量品红稀硫溶液, 点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察到
点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察到 的现象是___________________________
的现象是___________________________
 (4)在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:
(4)在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:
____________________________________________
 反应过程中,溶液的pH_____(填:变大、变小、不变)。
反应过程中,溶液的pH_____(填:变大、变小、不变)。

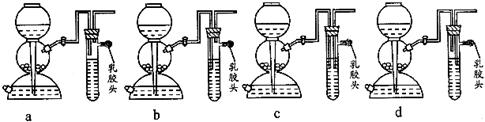
 (5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。
(5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。
上图的装置能起到此作用的是_____
 (6)已知硫化氢气体在空气中的体积分数为4.3%-45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是_______________
(6)已知硫化氢气体在空气中的体积分数为4.3%-45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是_______________
27.明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:
 明矾石 氨水 滤液¾®蒸发¾®结晶¾®过滤¾®钾氮混合肥料
明矾石 氨水 滤液¾®蒸发¾®结晶¾®过滤¾®钾氮混合肥料
 焙烧¾®浸出¾®过滤
滤液I
焙烧¾®浸出¾®过滤
滤液I
 沉淀物¾®溶解¾®过滤¾®水解¾®过滤¾®氢氧化铝
沉淀物¾®溶解¾®过滤¾®水解¾®过滤¾®氢氧化铝
氢氧化钠 氧化铁 空气 滤液II
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500 mL稀氨水(每升含有39.20 g氨)需要取浓氨水(每升含有250.28 g氨)_____mL,用规格为_____mL量筒量取。
(2)氨水浸出后得到固液混合体系,过滤,滤液中除K+、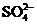 外,还有大量的
外,还有大量的 。检验
。检验 的方法是__________________________________________
的方法是__________________________________________
(3)写出沉淀物中所有物质的化学式__________________________
(4)滤液I的成分是水和__________
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
① 称取钾氮肥试样并溶于水,加入足量_____溶液,产生白色沉淀。
② __________、__________、__________(依次填写实验操作名称)。
③ 冷却、称重。
(6)若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为:________ (用含m、n的代数式表示)。
2009年
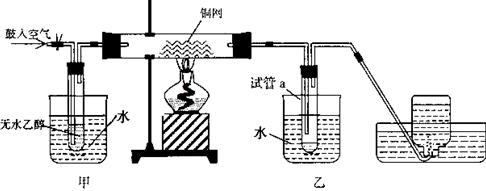
26.(B)某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
、 。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是_____反应。
(2)甲和乙两个水浴作用不相同。
甲的作用是____________________;乙的作用是____________________。
(3)反应进行一段时间后,干燥管a中能收集到不同的物质,它们是______________。集气瓶中收集到的气体的主要成分是____________________
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有_____
要除去该物质,可现在混合液中加入_____
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过__________(填试验操作名称)即可除去。
26.(A)如上图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。回答下列问题:
|
实验序号 |
甲针筒内物质 |
乙针筒内物质 |
甲针筒的现象 |
|
1 |
10 mL FeSO4溶液 |
10 mL NH3 |
生成白色沉淀,后变色 |
|
2 |
20 mL H2S |
10 mL SO2 |
|
|
3 |
30 mL NO2(主要) |
10 mL H2O(l) |
剩有无色气体,活塞自动向内压缩 |
|
4 |
15 mol Cl2 |
40 mL NH3 |
|
(1)实验1中,沉淀最终变为_____色,写出沉淀变色的化学方程式_________________
(2)实验2甲针筒内的现象是:有__________生成,活塞_____移动(填向外、向内、不)。
反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入 溶液中。
(3)实验3中,甲中的30 mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是_____,写出NO2与H2O反应的化学方程式_________________________________
(4)实验4中,已知:3Cl2+2NH3¾®N2+6HCl。甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为__________,最后针筒中剩余气体的体积约为_____mL。
27.将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
CaSO4·2H2O
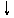
|
|
|
|
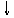


 H2O¾®
H2O¾®
|
|
|
|


 H2O¾®
H2O¾®
CaCl2·6H2O K2SO4
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要__________________等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
___________________________________________________________
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有__________(填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有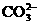 的方法是:________
_______________________________________
的方法是:________
_______________________________________
(5)已知不同温度下K2SO4在100 g水中达到饱和时溶解的量如下表:
|
温度(℃) |
0 |
20 |
60 |
|
K2SO4溶解的量(g) |
7.4 |
11.1 |
18.2 |
60℃时K2SO4的饱和溶液591 g冷却到0℃,可析出K2SO4晶体_____g。
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是_____
A.熔点较低(29℃熔化) B.能导电 C.能制冷 D.无毒
(7)上述工艺流程中体现绿色化学理念的是:________________________
2008年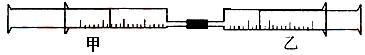
26.(A)实验室模拟合成氨和氨催化氧化的流程如下:
 制取N2
制取N2
¾®气体混合¾®合成氨¾®氨吸收¾®氨氧化
制取H2
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从右图中选择制取气体的合适装置:氮气_____、氢气_____。
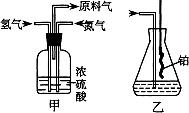 (2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有____________、____________。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有____________、____________。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,_____(填:会、不会)发生倒吸,原因是____
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是__________,锥形瓶中还可观察到的现象是_________
(5)写出乙装置中氨氧化的化学方程式_________________________________
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、_____、_____离子。
 (B)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为: ¾¾¾¾途径I¾¾¾¾
(B)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为: ¾¾¾¾途径I¾¾¾¾
 杂铜¾®粗制氧化铜
硫酸铜溶液¾®胆矾(CuSO4·H2O)
杂铜¾®粗制氧化铜
硫酸铜溶液¾®胆矾(CuSO4·H2O)
¾¾途径II:稀硫酸,加热通氧气¾¾
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于_____上(用以下所给仪器的编号填入,下同),取用坩埚应使用_____,灼烧后的坩埚应放在_____上,不能直接放在桌面上。
a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是_____
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、__________、冷却结晶、__________、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:____________________、____________________。
(5)在测定胆矾(CuSO4·xH2O)中结晶水x值实验过程中,称量操作至少进行_____次。
(6)若测定结果x值偏高,可能的原因是_____
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
27.
 蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下: HCl
Ca(OH)2 Ca(OH)2
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下: HCl
Ca(OH)2 Ca(OH)2
 蛇纹石¾®溶解(pH<1)¾® I
¾®
II ¾®Mg(HCO3)2(热解)¾®碱式碳酸镁
蛇纹石¾®溶解(pH<1)¾® I
¾®
II ¾®Mg(HCO3)2(热解)¾®碱式碳酸镁
SiO2¯ 沉淀物A CO2 沉淀物B
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是__________
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)。
|
会导致_________溶解、_________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入__________(填化学式),然后________________________________________(依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是______________
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
① 样品称量,② 高温分解,③ _______________,④ _______________,⑤ MgO称量。
(6)18.2 g产品完全分解后,产生6.6 g CO2和8.0 g MgO,由此可知,产品的化学式中:a=_____,b=_____,c=_____。
2007年
26.(B)某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。

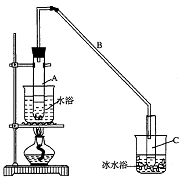
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至
反应完全,在试管C内得到环己烯粗品。
① A中碎瓷片的作用是__________,导管B除了导气外还具有的作用是____________
② 试管C置于冰水浴中的目的是______________________________________________
(2)制备精品
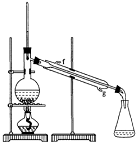 ① 环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层(填:上、下),分液后用_____洗涤。
① 环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层(填:上、下),分液后用_____洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
② 再将环己烯按右图装置蒸馏,冷却水从_____口进入。蒸馏时要加入生石灰,目的是____________________
③ 收集产品时,控制的温度应在_____左右,实验制得的环己烯精品质量低于理论产量,可能的原因是_____
a.蒸馏时从70℃开始收集产品 b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_____
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
26.(A)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为V mL(已折算成标准状况),由上述实验事实可知:
(1)① 固体M中一定有的物质是__________(填化学式)理由是_________________
② 其中一种物质的质量可以确定为__________g(用代数式表示)。
(2)B装置的名称是__________
写出B装置中反应的离子方程式________________________________
(3)C装置的作用是_____________,如果实验中没有B装置,则C装置中产生的现象是_____________________________________________________
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是__________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是________________
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____
a.M中有未反应的铁和硫 b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体 d.气体进入D装置前未用浓硫酸干燥
27.聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:
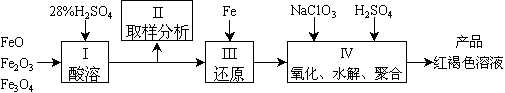
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有_____
(a)容量瓶 (b)烧杯 (c)烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是_____
(a)控制溶液中Fe2+与Fe3+ 含量比 (b)确定下一步还原所需铁的量
(c)确定氧化Fe2+所需NaClO3的量 (d)确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4+NaClO3+3H2SO4¾®3Fe2(SO4)3+NaCl+3H2O
若改用HNO3氧化,则反应方程式如下:
6FeSO4+2HNO3+3H2SO4¾®3Fe2(SO4)3+NO+4H2O
已知1 mol HNO3价格0.16元、1 mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊,利是_________________________,弊是_________________________
聚合硫酸铁溶液中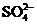 与Fe3+物质的量之比不是3︰2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中
与Fe3+物质的量之比不是3︰2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中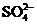 与Fe3+物质的量之比_____
与Fe3+物质的量之比_____
(4)测定时所需的试剂_____
(a)NaOH (b)FeSO4 (c)BaCl2 (d)NaClO3
(5)需要测定和的质量(填写化合物的化学式)_____
(6)选出测定过程中所需的基本操作(按操作先后顺序列出)。
(a)萃取、分液 (b)过滤、洗涤 (c)蒸发、结晶 (d)冷却、称量 (e)烘干或灼烧
2006年
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com