
题目列表(包括答案和解析)
 CH3COOH+C2H5OH
CH3COOH+C2H5OH  CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有 、
等。
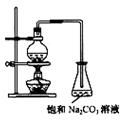
(2) 若用右图所示装置来制备少量的乙酸乙酯,产率往往偏低,
其原因可能为 、
等。
(3)此反应以浓硫酸为催化剂,可能会造成 、 等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,
且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)
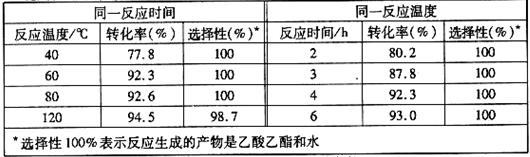
①根据表中数据,下列 (填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
② 当反应温度达到120℃时,反应选择性降低的原因可能为
实验室模拟合成氨和氨催化氧化的流程如下:
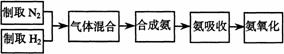
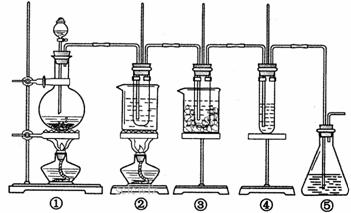
图中: ① 为氯气发生装置; ②的试管里盛有15mL30 % KOH 溶液,并置于水浴中; ③ 的试管里盛有 15 mL 8 % NaOH 溶液,并置于冰水浴中; ④ 的试管里加有紫色石蕊试液; ⑤ 为尾气吸收装置。
请填写下列空白:
( l )制取氯气时,在烧瓶里加入一定量的二氧化锰,通过________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在 ① 与 ② 之间安装盛有___________(填写下列编号字母)的净化装置。
 A .碱石灰 B .饱和食盐水 C .浓硫酸 D .饱和碳酸氢钠溶液
A .碱石灰 B .饱和食盐水 C .浓硫酸 D .饱和碳酸氢钠溶液
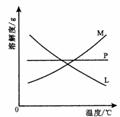
( 2 )比较制取氯酸钾和次氯酸钠的条件,二者的差异是:_ _ _ _ __ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 反应完毕经冷却后, ② 的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是_ _ _ _ _ _ _(填写编号字母);从 ② 的试管中分离出该晶体的方法是_ _ _ _ _ _(填写实验操作名称)。
( 3 )本实验中制取次氯酸钠的离子方程式是:_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
( 4 )实验中可观察到 ④ 的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为_色 |
氯气与水反应生成的 H +使石蕊变色 |
|
随后溶液逐渐变为无色 |
_ _ _ _ _ _ _ _ _ _ _ _ |
|
然后溶液从无色逐渐变为_色 |
_ _ _ _ _ _ _ _ _ _ _ _ |
①2Mg+O2 2MgO;②3Mg+N2
2MgO;②3Mg+N2  Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2 2MgO+C
2MgO+C
④Mg+H2O MgO+H2↑ ⑤Mg3N2 +6H2O
MgO+H2↑ ⑤Mg3N2 +6H2O  3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
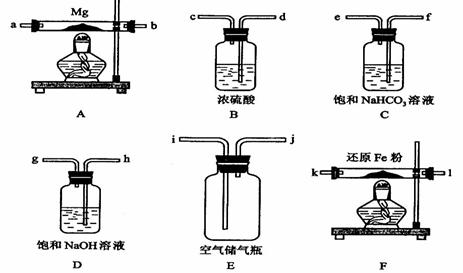
回答下列问题;
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别______________________________________;
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)___________________ _;
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?__________,原因是____________________;
(4)请设计一个实验,验证产物是氮化镁:
______________________________________________________________________
 已知:
已知: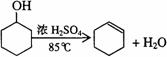
|
|
密度
(g/cm3) |
熔点
(℃) |
沸点
(℃) |
溶解性 |
|
环己醇 |
0.96 |
25 |
161 |
能溶于水 |
|
环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
(1)制备粗品
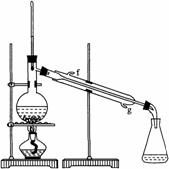
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是__________,导管B除了导气外还具有的作用是__________。
②试管C置于冰水浴中的目的是___________________________________________。
(2)制备精品
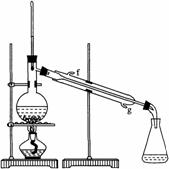 ①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________(填入编号)洗涤。
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________(填入编号)洗涤。
A KMnO4溶液 B 稀H2SO4 C Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从________口进入。蒸馏时要加入生石灰,目的是__________________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是( )
A 蒸馏时从70℃开始收集产品 B 环己醇实际用量多了
C 制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
A 用酸性高锰酸钾溶液 B 用金属钠 C 测定沸点
可用右图装置制取(必要时可加热)、净化、收集的气体是
A 铜和稀硝酸制一氧化氮 B 稀硫酸与石灰石制取二氧化碳
C 锌和稀硫酸制氢气 D 硫化亚铁与稀硫酸制硫化氢
4、错误地理解△H中+、-号的意义。
(各位同学可把自己的易错知识归纳补充于此。)
3、忽视物态对热化学方程式中△H的影响(如水的固、液、气态)
2、忽视题目中要求的限定
如:要求表达燃烧热、中和热等,系数就不能任意改变
1、可逆反应中计量系数与实际反应量的问题
已知热化学方程式:N2(g)+3 H2(g) 2
NH3(g);ΔH=-92.2 kJ·mol-1
2
NH3(g);ΔH=-92.2 kJ·mol-1
现有a、b两个反应器,a中充入1 mol N2与3 mol H2,b中充入1 mol N2与6 mol H2,反应放出的热分别是Qa和Qb,则 ( )
A.Qa<Qb<92.2 kJ B.Qa=Qb<92.2 kJ
C.Qa=Qb=92.2 kJ D.Qa<Qb=92.2 kJ
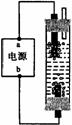
右图A为直流电源,B为渗透饱和
氯化钠溶液和酚酞试液的滤纸,C为电镀槽,
接通电路后,发现B 上的 C 点显红色,
请填空:
(1)电源A的a为 极。
(2)滤纸B上发生的总反应方程式为:
。
(3)欲在电镀槽中实现铁上镀锌,接通K点,
使c、d两点短路,则电极e上发生的反应为: ,电极f上发生的反应为: ,槽中盛放的镀液可以是 或
 (只要求填两种电解质溶液)。
(只要求填两种电解质溶液)。
(1)正 (2)2NaCl+2H2O H2↑+Cl2↑+2NaOH
(3)Zn-2e = Zn2+, Zn2++2e = Zn,ZnSO4溶液或ZnCl2溶液
 某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
15、一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料说法正确的是
A、在熔融电解质中,O2-由负极移向正极
B、电池的总反应是:2C4H10 + 13O2 → 8CO2 + 10H2O
C、通入空气的一极是正极,电极反应为:O2 + 4e- = 2O2-
D、通入丁烷的一极是正极,电极反应为:C4H10 + 26e- + 13O2-= 4CO2 + 5H2O
(特别注意O在电极反应方程式中书写的变化)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com